硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
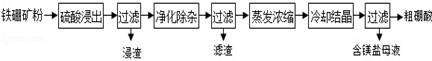
回答下列问题:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式
为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有 (写出两条)。
(2)利用 的磁性,可将其从“浸渣”中分离.“浸渣”中还剩余的物质是 (化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是 然后在调节溶液的pH约为5,目的是 。
(4)“粗硼酸”中的主要杂质是 (填名称).
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为
(6)单质硼可用于生成具有优良抗冲击性能硼钢.以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程 。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
| Ksp |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀pH |
≥9.6 |
≥6.4 |
≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有(写两种)。
(2)加入双氧水可能发生反应的离子方程式为;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是 。
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
(5)在溶液N中加入乙醇的目的是 。
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:
(1)实验室实现“操作Ⅰ”所用的玻璃仪器有 、玻璃棒和烧杯。“操作Ⅲ”系列操作名称依次为 、 、过滤和洗涤。
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式为。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是。
(4)实验室检验“反应Ⅰ”已经完全的试剂是 ,现象是。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:。
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。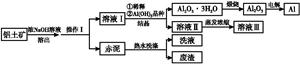
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有。
(2)为了提高铝土矿的溶出速率可采取的有效措施为(任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的C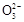 、HC
、HC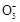 、Al
、Al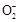 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是()
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是()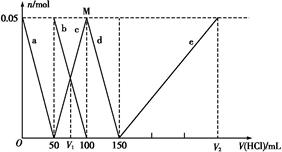
A.原混合溶液中的C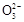 与Al 与Al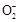 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.V1∶V2=1∶5 |
| C.M点时生成的CO2为0.05 mol |
D.a线表示的离子方程式为:Al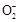 +H++H2O +H++H2O Al(OH)3↓ Al(OH)3↓ |
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备
甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成C ,然后以C
,然后以C 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极电极反应式: 。