亚硝酸钠易溶于水,有碱味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
______NaNO2 + _______KI + _______ _______NO +______I2 +______K2SO4 +______Na2SO4+_______
_______NO +______I2 +______K2SO4 +______Na2SO4+_______
(1)请完成该化学方程式并配平。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了_______________个。
(3)现有25.00 mL的KI溶液,用酸化的10.00 mL 0.0500 mol/L的KIO3溶液处理(5I- + IO3- +6H+ = 3I2 + 3H2O)。将生成的I2全部除去后,再加入过量的KI溶液,使之与剩余的KIO3反应,然后将溶液调节至中性,析出的单质碘用0.1000 mol/L的Na2S2O3溶液滴定(2S2O32- + I2 = S4O62- + 2I-),用去该溶液的体积为21.00 mL。求剩余的KIO3为 mol,原KI溶液的物质的量浓度是 mol/L
(I)多项选择题
化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
| A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 |
| B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
C.为了有效的发展清洁能源,采用电解水的方法大 量制备H2 量制备H2 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
E.利用化学反应原理,设计和制造新的药物
(II)
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。
(1)海水淡化工厂通常采用的制备淡水的方法有(写出两种)。
(2)下图是从浓缩海水中提取溴 的流程图。写出下图中①②的化学式:①,②,吸收塔中发生的化学反应方程式为。
的流程图。写出下图中①②的化学式:①,②,吸收塔中发生的化学反应方程式为。
(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3 SiCl4(g)+2 H2(g)+Si(g) 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为kg。
质量为kg。
(I)多项选择题
下列说法中正确的是。
| A.丙烯分子中有8个σ键,1个π键 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 |
| D.NCl3和BC13分子中,中心原子都采用sp3杂化 |
E.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
(II)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是,其中Ti4+的氧配位数为,Ba2+的氧配位数为,
(3)常温下的TiCl4是有刺激性臭味的无 色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是化合物,其固体是晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有生成。
色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是化合物,其固体是晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有种同分异构体,请在下图方框中将其画出。
(I)多项选择题
下列合成路线中,涉及到的反应类型有_________。
| A.加成反应 | B.氧化反应 | C.还原反应 |
| D.加聚反应 E.缩聚反应 |
(II)
(1)A的含氧官能团的名称是。
(2)A在催化剂作用可与H2反应生成B,该反应的反应类型是。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是。
(4)A发生银镜反应的化学方程式是。
(5)扁桃酸( )有多种同分异构体。属于甲酸酯且含酚羟基的同分异
)有多种同分异构体。属于甲酸酯且含酚羟基的同分异
构体有种,写出 其中一个含亚甲基(-CH2-)的同分异构体的结构简式
其中一个含亚甲基(-CH2-)的同分异构体的结构简式
______________。
(6)N在NaOH溶液中发生水解反应的化学方程式是。
由A和其他无机原料合成环状化合物E,其合成过程如下:(水及其他无机产物均已省略)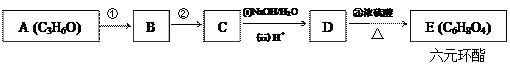
已知:RCH2Cl→RCH2OH,A的分子中不含甲基,且能使溴水褪色。试回答下列问题:
(1)写出结构简式:A__________________,D__________________;
(2)图中①的反应类型是_____________;
(3)写出反应③的化学方程式:________________________________________。
下图各物质是中学化学中常见的 物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲可作发酵粉,乙是一种常用的化肥。B、D常温下是气体。请回答下列问题:
物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲可作发酵粉,乙是一种常用的化肥。B、D常温下是气体。请回答下列问题:
(1)甲的俗名是________________。
(2)D的水溶液滴入酚酞试液后,溶液显红色,说明D溶液显____性,请用必要的文字加以解释并写出相关的离子方程式:____________。
(3)乙溶液与过量的KOH溶液共热,试写出反应的离子方程式:_____________。