请结合下列实验常用装置,回答有关问题.
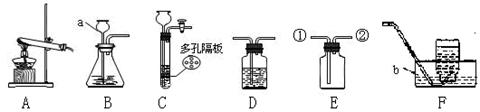
(一)(1)若用B、F组成制取某气体的装置,写出制取此气体的化学方程式为 ,若要获得干燥的二氧化碳,除发生装置外,还应选用D装置,并在该装置中盛放 试剂(填写试剂名称).如果用E装置收集该气体则气体从 端进入(填“①”或“②”)。
(2)乙炔(C2H2)是无色、无味、易燃的气体,乙炔的密度比空气略小,难溶于水。乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体)与水反应生成,同时生成一种白色固体。已知碳化钙与水反应非常剧烈。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是 。
(二)实验室里有一瓶常用的无色溶液,因保管不当,其残缺的标签中只剩下“Na”和“10%”字样(如图所示).
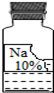
小强和小华同学很感兴趣,决定对其成分进行探究.
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ初中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3.
ⅡNa2CO3和NaHCO3的水溶液都呈碱性.
Ⅲ室温(20℃)时,测定四种物质的溶解度数据如下:
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 溶解度g |
36 |
109 |
215 |
9.6 |
小华根据试剂瓶标注的质量分数为10%和上表中的溶解度数据判断,这瓶试剂不可能是
【作出猜想】①可能是NaCl;②可能是Na2CO3;③可能是
【实验探究】
(1)小强用洁净的玻璃棒蘸取试液于pH试纸上,测得pH>7,则这瓶试剂不可能是
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验.
| 实验步骤 |
实验现象 |
结论及化学方程式 |
| 取少量溶液于试管中,滴加 |
产生大量气泡 |
反应的化学方程式: |
| ② 把产生的气体通入澄清的石灰水中. |
澄清的石灰水变浑浊 |
猜想②正确. 反应的化学方程式: |
干冰是固态的二氧化碳,在常温下易升华,右图是干冰升华时的情景,根据图中信息,从“ ”这一角度分析干冰具有的性质和用途
”这一角度分析干冰具有的性质和用途
(1)干冰升华时(填“吸收”或“放出”)大量热,因此可作致冷剂
或用于人工降雨。
(2)干冰转化成二氧化碳气体后能参与绿色植物的光合作用,绿色植物通过光合作用吸收二氧化碳,同时放出(填名称)。
(3)将干冰转化成的二氧化碳气体通入紫色石蕊试液,可看到_____的现象,原因是:(用化学方程式表示)__________________,加热后可看到____________ __的现象。
(4)大气中二氧化碳等气体的含量过高,容易造成“温室效应”.为了减缓“温室效应”,以下建议中合理的是(填序号)。
①开发太阳能、水能、风能、地热等能源;②减少化石燃料的使用;
③大量植树种草,禁止乱砍滥伐。
( 5 )近年来大气中二氧化碳含量不断上升的主要原因是
( 6 )下列变化中,对维持大气中二氧化碳气体总量平衡至关重要的是(填序号)
| A.CO2+H2O=H2CO3 | B.6CO2+6H2O C6H12O6+6O2 C6H12O6+6O2 |
C.CO2+C 2CO 2CO |
D.CO2+2NaOH=Na2CO3+H2O |
已知碘元素(元素符号为I)的原子结构示意图为,请回答下列问题。
(1)x的值为。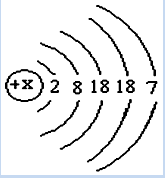
(2)“加碘食盐”中一般加入碘酸钾(化学式为KIO3),碘元素化合价为 。
(3)一般情况下,元素原子的最外层电子数相同,具有相似的化学性质。碘元素的化学性质与下列元素的化学性质最相似的是。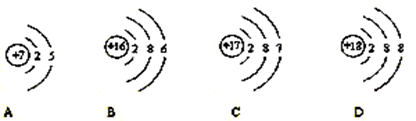
用数字和化学符号填空:
(1)2个氮原子_________________;(2)2个氧离子_________________;
(3)2个二氧化硫分子______________;(4)氧化铝中铝元素化合价为+3价_____________
实验室常用下列装置来制取氧气: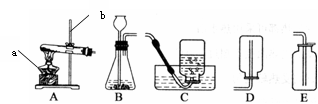
(1)写出图中有标号仪器的名称:a、b;
(2)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是(填序号),用该装置还能制取气体。发生反应的化学方程式为。
(3)用E装置收集氧气的依据是,检验氧气是否集满的方法是。 (4)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水,其水溶液呈碱性。
(4)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水,其水溶液呈碱性。
①制取氨气反应的方程式2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2X。X的化学式为:。
②制取并收集NH3,应该从上图中选择的发生装置是 ___,收集装置是_________。
③NH3是一种碱性气体,干燥时不能选用下列干燥剂中的(填序号)。
A.固体氢氧化钠B.浓硫酸 C.生石灰
课堂上同学们利用甲图所示装置做过氧化氢制氧气的实验时,用带火星的木条检验氧气,带火星的木条很难复燃。于是老师将甲装置进行了改进,如乙图,带火星的木条较易复燃。(图中的铁架台均已略去)请回答: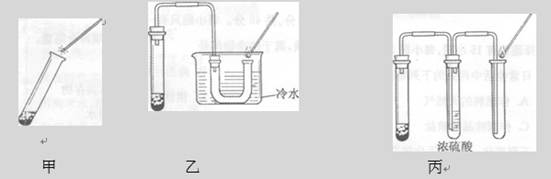
(1)写出实验室用过氧化氢和二氧化锰制取氧气的化学方程式: ________________
二氧化锰在反应中作剂,其作用是 ______。
(2)分析改用乙装置后,带火星的木条较易复燃的原因:______________________。
(3)老师又设计了另一个改进的丙装置,带火星的木条也易复燃。根据(2)推测的原因,分析浓硫酸的作用:。
(4)你还能写出实验室用到二氧化锰制取氧气的反应化学方程式吗?_____________。