(1)对于中学化学常见物质:钠、铁、氧化钠、过氧化钠、二氧化硫、二氧化氮.根据它们在一定条件下能否与H2O发生氧化还原反应进行的分类如下:

请回答下列问题:
①淡黄色固体属于 (从“甲~丁”选填)组,乙组中物质包括 (填写电子式).
②甲组中的物质能使溴水褪色,其反应的离子方程式为 .
③丙组中的某一物质须在高温时才能与水蒸气反应,其化学方程式为 .另一物质投入足量的Ca(HCO3)2溶液中反应产生气体和沉淀,写出生成沉淀的离子方程式为 .
(2)用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
①Al与NaOH溶液反应的离子方程式为___________________。
②焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是__________。
③经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2 CH3OCOOC2H5(g) ΔH1
2 CH3OCOOC2H5(g) ΔH1
(1)其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R)的关系如图所示。
①ΔH1______0(填“<”、“=”或“>”)。
②由图可知,为了提高CH3OCOOCH3的平衡转化率,除了升温,另一措施是___________。
③在密闭容器中,将1mol C2H5OCOOC2H5和1mol CH3OCOOCH3混合加热到650K,利用图中的数据,求此温度下该反应的平衡常数K(请写出计算过程)。
(2)已知:CH3OCOOCH3(g) + C2H5OH(g) CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + C2H5OH(g) C2H5OCOOC2H5(g) + CH3OH(g)ΔH3
C2H5OCOOC2H5(g) + CH3OH(g)ΔH3
ΔH1=____________________(用ΔH2和ΔH3表示)
(3)已知上述反应需要催化剂,请在答题卡的坐标图中,画出有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(共16分)A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示: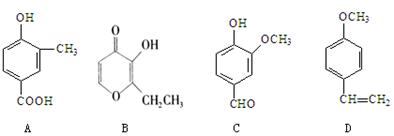
(1)化合物A的分子式是;A中含有的官能团的名称是;
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号);
(3)化合物B的核磁共振氢谱中出现组峰;
(4)1mol D最多能与mol的氢气发生加成反应;1mol D与足量Br2水混合,最多能和mol Br2发生反应;
(5)A与乙二醇(HOCH2CH2OH)以物质的量2:1反应生成一种酯和水,请写出该反应的化学方程式(注明反应条件):。
(6)已知C的一种同分异构体满足:①能够发生水解反应;②能够发生银镜反应;③能够使FeCl3溶液显紫色;④苯环上的一氯代物有2种。请写出它的结构简式。
(19分) A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:__________________________________________。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_____________________________________________________________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______,检查其中刺激性气体产物X的方法是____________________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_____________。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______盐,X极易溶于水的原因是:________________________________________________。
氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)利用ClO2氧化氮氧化物反应过程如下: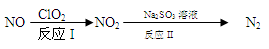
反应I的方程式是2NO+ClO2+H2O ="=" NO2+HNO3+HCl,该反应的氧化产物为,
反应II的化学方程式为。
(2)可用甲烷催化还原氮氧化物。已知:
CH4(g) + 4NO2(g) ="==" 4 NO(g) + CO2(g) + 2H2O(g)ΔH1
CH4(g) + 4NO(g) ="==" 2 N2(g) + CO2(g) + 2H2O(g)ΔH2
①已知NO气体会分解为NO2气体和N2气体,写出该反应的热化学方程式。
②现有一份NO与NO2的混合气体,其平均相对分子量为34,用16g甲烷气体催化还原该混合气 体,恰好完全反应生成氮气,二氧化碳气体和水蒸气,共放出热量1042.8kJ。则该混合气体中NO和NO2的物质的量之比为,若已知上述反应ΔH2= —1160 kJ·mol-1,则ΔH1=。
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2— 形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题
电极b是极,电极反应式为,
(2)右池是池,电极c的电极反应式为,
(3)通电2min后,Al电极质量减轻2.7g,则产生氮气的体积为。(标准状况)