(1)常温下将0.2 mol•L-1 HCl溶液与0.2 mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2 mol•L-1HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②混合溶液中c(Cl-)-c(M+)= mol•L-1。(填精确计算结果)
(2)常温下若将0.2 mol•L-1 MOH溶液与0.1 mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,若溶液的pH不等于7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000 mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1000 mol•L-1 HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
20.00 |
| 2 |
25.53 |
20.00 |
| 3 |
27.85 |
20.00 |
①待测NaOH溶液的物质的量浓度为 mol•L-1。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
A、B、C、D均为含有18个电子且由两种短周期元素组成的化合物分子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。请回答下列问题:
(1)C、D分子中相对原子质量较大的两种元素中第一电离能较大的是(用元素符号回答);从原子结构角度解释原因是。
(2)B的空间构型为,该分子属于分子(填“极性”或“非极性”),D分子中心原子的杂化方式是。
(3)C为一种绿色氧化剂,有广泛应用,Cu、氨水与C反应生成深蓝色溶液,在该深蓝色的浓溶液中加入乙醇所产生的现象是______。
写出Cu、氨水、C反应的离子方程式:____________________________________。
A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
| A |
宇宙中含量最丰富的元素 |
| B |
最外层电子数是次外层电子数的2倍 |
| C |
最高价氧化物对应的水化物与其氢化物反应生成盐 |
| D |
原子核外电子有8种不同的运动状态 |
| E |
基态原子核外有六个未成对电子 |
| F |
原子最外层只有一个电子 |
回答下列问题:
(1)基态E原子的核外M层电子云有种不同的伸展方向,基态E原子核外价电子排布式为,元素F属于区。
(2)A与C形成的最简单分子的空间构型为,中心原子的杂化方式为。
(3)B,C,D的第一电离能由大到小的顺序是(用元素符号表示);由B,C,D中的两种元素组成的常见分子互为等电子体的是和
(4)E元素可以形成配位数为6的两种配合物,它们的化学式都是ECl3﹒6H2O,其中一种呈亮棕色,与硝酸银溶液反应时,能沉淀出1/3的氯元素,该配合物可表示为。
(5)元素F的一种氯化物的晶胞结构如图所示(黑球表示F原子,白球表示氯原子),每个氯原子周围与之距离最近的氯原子个数为;若晶胞的密度为4.14g﹒cm-3,该晶胞的边长为cm(只要求列算式,不必计算出数值,阿附加德罗常数的数值为NA)
(8分)化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图: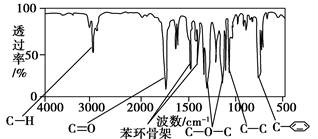
已知:A分子中只含有一个苯环,且苯环上只有一个取代基,试填空。
(1)A的分子式为__________;
(2)A的结构简式可能为__________;
(3)A的芳香类同分异构体有多种,其中分子中不含甲基的芳香酸为__________
钙,铝,铜都是中学化学常见的金属元素。
(1)Cu的基态原子的价电子排布图为
(2)基态Al原子中,电子占据的最高能层符号为,该能层具有的原子轨道数为,电子数为。
(3)Cu2O的熔点比Cu2S的高,其原因是
(4)CaC2是制备乙炔的原料,C22-与O22+互为等电子体,O22+的电子式可表示为,
1个O22+中含有个π键。
(5)AlCl3,NH3和AlCl4-中均含有配位键。在AlCl3﹒NH3中,提供空轨道的原子是,在AlCl3,NH3中Al原子采取杂化。
(8分,多选错选不得分)现有下列物质, 用编号填空回答下列问题:
A.干冰
B.金刚石
C.氦
D.过氧化钠
E.二氧化硅
F.氯化铵
(1)通过非极性键形成的原子晶体是:。
(2)可由原子直接构成的晶体是:。
(3)含有离子键、共价键、配位键的化合物是:。
(4)含有非极性键的离子化合物是:。
(5)已知微粒间的作用力包括离子键、共价键、金属键、范德华力、氢键 。氯化钠熔化,粒子间克服的作用力为____________;二氧化硅熔化,粒子间克服的作用力为____________;干冰气化,粒子间克服的作用力为____________。A、B、C、D四种物质的熔点从低到高的顺序为____________________(填序号)。