某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: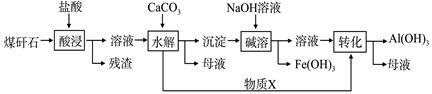
(1)“酸浸”过程中主要反应的离子方程式为:_____________、_____________。
(2)“酸浸”时,提高浸出速率的具体措施有_____________、_____________。(写出两个)
(3)“碱溶”的目的是_____________。物质X的化学式为_____________。
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_____________。
(5)若根据过滤出的Fe(OH)3沉淀来推算煤矸石中Fe2O3 的含量,须将沉淀清洗干净,检验沉淀是否洗干净的具体操作方法是_______________。
(12分)A~F都是有机化合物,它们的转化关系如下: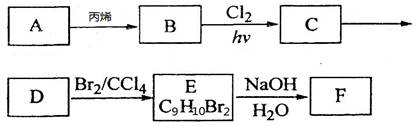
请回答下列问题:
(1)已知:烃A的蒸气与氢气的相对密度为39,则A的分子式为_______________:
(2) 由A生成B的反应类型是____________;由C生成D的反应条件_____________;
(3) C有2种结构,其结构简式分别为______________________________;
(4) 已知化合物G(C8H6O4)是B的一种同分异构体与酸性高锰酸钾溶液反应后的产物,G核磁共振氢谱有两组峰,且峰面积比为l:2,写出G与F生成高分子化合物的结构简式为___________________________________________________;
(5)在E的同分异构体中,含三个甲基的芳香族化合物共有___________种。
(10分)已知葡萄中含有酒石酸。酒石酸的化学分析如下:①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C、H质量分数分别为w(C)=32%和w(H)=4%;②1 mol该酸与足量的NaHCO3反应放出44.8 L CO2,与足量的Na反应放出44.8 L H2(气体体积均已折算为标准状况);③该分子中存在二种化学环境不同的碳原子,三种化学环境不同的氢原子。回答下列问题:
(1)酒石酸的分子式为,分子中有________个羧基和________个羟基。
(2)写出酒石酸的结构简式____________________________。
(3)酒石酸的同分异构体中,符合上述①、②两个条件的有(写出结构简式):
。
(8分)环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。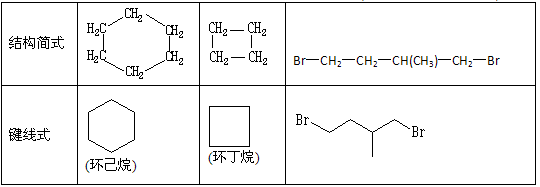
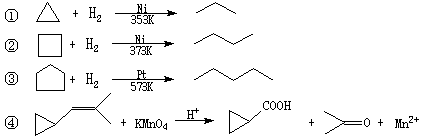
回答下列问题:
(1)写出与环丙烷不同类别但互为同分异构体的有机物的结构简式________________。
(2)反应①~③的反应类型是____________,其中最容易发生此类反应的环烷烃是(填名称)。
(3)环烷烃还可以与卤素单质、卤化氢发生类似①~③的反应,如环丙烷与Br2可在一定条件下发生反应,反应得到的产物名称为____________,键线式____________,该物质还有_______种同分异构体。
(4)要鉴别环己烷和己烯,可选用的试剂是;现象与结论是____________________________________________________________。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: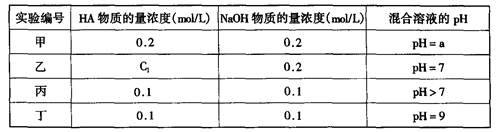
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸;
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L(选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是;
| A.前者大 | B.后者大 | C.二者相等 | D.无法判断 |
(3)从丙组实验结果分析,HA是酸(选填“强”或“弱”);
该混合溶液中离子浓度由大到小的顺序是;
(4)丁组实验所得混合溶液中由水电离出的c(OH—)=mol/L;
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。c(Na+)-c(A—)=mol/L。
(12分)
(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了。稀释后还需要加入一些铁粉,其目的是,相关反应的离子方程式为。
(2)氯化铁水溶液呈性,原因是(用离子方程式表示):_______________ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是。