下列依据热化学方程式得出的结论正确的是
A.已知H2(g)+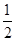 O2(g)=H2O(g);△H=-241.8 kJ·mol—1,则氢气的燃烧热为241.8 kJ·mol—1 O2(g)=H2O(g);△H=-241.8 kJ·mol—1,则氢气的燃烧热为241.8 kJ·mol—1 |
| B.已知C(石墨,s)=C(金刚石,s); △H= +1.9kJ·mol—1,则石墨比金刚石稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ· mol—1,则含1mol NaOH的稀溶液与1mol的稀醋酸完全中和,放出的热量也等于57.3kJ |
| D.已知2C(s)+2O2(g)=2CO2(g)) △H="a" kJ·mol—1、2C(s)+O2(g)=2CO(g)△H="b" kJ· mol—1,则a>b |
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol/(L·s) |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
D.若升高 温度,X的体积分数增大,则该反应的DH>0 温度,X的体积分数增大,则该反应的DH>0 |
在密闭容器中进行如下反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是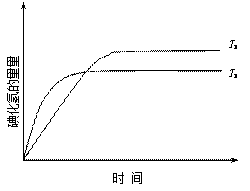
| A.T1>T2,ΔH>0 | B.T1>T2,ΔH<0 |
| C.T1<T2,ΔH>0 | D.T1<T2,ΔH<0 |
已知:C(s)+CO2(g) 2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);DH =-2878 kJ·mol-1
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);DH =-2869 kJ·mol-1
下列说法正确的是
| A.正丁烷分子储存的能量大于异丁烷分子 |
| B.正丁烷的稳定性大于异丁烷 |
| C.异丁烷转化为正丁烷的过程是一个放热过程 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=2×283.0 kJ·mol-1 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |