I.甲、乙两池电极材料都是铁棒与碳棒(如图)。请回答下列问题:
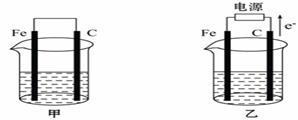
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒。
②在乙池中阴极的电极反应式是________________________________。
(2)若两池中均盛放饱和NaCl溶液。
①写出甲池中负极的电极反应式__________________________________。
②写出乙池中的总反应的离子方程式______________________________。
II.我国在青藏高原发现了名为“可燃冰”的环保型新能源。
(1)CH4可与Cl2反应,反应历程如下
①Cl2→2Cl ΔH =" 243" kJ·mol-1
②Cl+CH4→CH3+HCl ΔH =" 4" kJ·mol-1
③CH3+Cl2→CH3Cl+Cl ΔH =" -106" kJ·mol-1
则CH4与Cl2反应生成CH3Cl(g)的热化学方程式为 __。
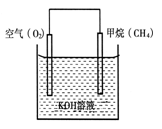
(2)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如图所示:则通入CH4的一极为原电池的 (填“正极”或“负极”),负极的电极反应式为 。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
聚合过程主要利用了Al3+的性质是。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
聚合铝(PAC)的分子式为[Al2(OH)aCl b]m,聚合铝中OH-与Al3+的比值对净水效果有很大影响,定义盐基度B=n(OH-)/3n(Al3+),当B=2/3时,b =(填入合适数字)。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
用36.5%的盐酸配制20%的盐酸,操作步骤是(依次写出),配制过程中所需的定量仪器是。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
写出铝、氧化铝分别与盐酸反应的离子方程式:
,,
A是该周期中(除稀有气体元素外)原子半径最大的元素,从原子结构上看其原因是________________________________________________。A、B、C三元素形成简单离子的半径大小顺序为____________。(用离子符号表示)
比较A、B单质活泼性的实验方法是__________________________________________。