在对蜡烛及其燃烧进行了探究以后,请你填写下列空格:
(1)取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛会 。结论:石蜡的密度比水 。
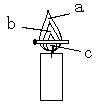
(2)点燃蜡烛,观察到蜡烛的火焰分为三层,分别是 、 、 。把一根火柴梗放在蜡烛的火焰上(如右图),约1取出,可以看到在 处(填字母)的火柴梗的最先碳化。结论:蜡烛火焰的 温度最高。
(3)在探究蜡烛燃烧的过程中发现罩在火焰上方的烧杯内壁被熏黑,以下做法不合适是( )
| A.反复实验,并观察是否有相同现象 |
| B.查找资料,了解蜡烛的主要成分,探究生成的黑色固体是什么 |
| C.认为与本次实验无关,不予理睬 |
| D.询问老师或同学,讨论生成黑色物质的原因 |
(4)芳芳认为蜡烛燃烧过程中既有化学变化,也有物理变化,而婷婷认为只有化学变化,你同意_______的观点,理由是_________________
为了验证二氧化碳与氢氧化钠可以发生化学反应,某小组用下图所示装置进行实验。请回答下列问题: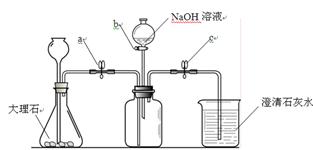
(1)打开止水夹a和c,从长颈漏斗向锥形瓶中注入稀盐酸至时停止。
(2)当观察到烧杯中有大量白色沉淀产生时,说明集气瓶中已集满二氧化碳气体。然后进行的操作是,关闭活塞b,轻轻振荡集气瓶。一段时间后可观察到,证明二氧化碳与氢氧化钠发生了化学反应,该反应的化学方程式为。
(3)小红认为仅做上述实验有不足之处,应利用上图装置做一个对比实验。该对比实验只需将所用的氢氧化钠溶液换成即可。
(4)为了保证实验的成功,应在实验前对装置的气密性进行检验(不另加仪器),方法为。
(7分)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料。某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理。
【查阅资料】
1.Cu2(OH)2CO3 2CuO+CO2 + H2O
2CuO+CO2 + H2O
2CuO+C 2Cu + CO2 ↑
2Cu + CO2 ↑
2.CuO为黑色固体,化学性质和氧化铁相似。
(1)实验l:加热分解碱式碳酸铜。装置如图所示。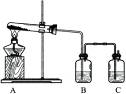
①A中固体的变化为____。
②欲证明反应后有水生成,B中所盛试剂为____。
③反应结束时的操作应该是____,理由是____。
(2)实验2:木炭和氧化铜反应。
将木炭粉末和氧化铜粉末混合均匀,放进试管加热,反应后将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余。该小组同学设计方案验证黑色粉末的成分。
【作出猜想】
剩余黑色粉末可能是:①氧化铜;②木炭;③木炭和氧化铜。
【实验验证】填写下表。
| 实验操作及现象 |
实验结论 |
| 该黑色粉末为氧化铜 |
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比,设计方案如下:
| 配方l |
配方2 |
配方3 |
配方4 |
|
| 木炭质量(g) |
0.4 |
0.5 |
0.6 |
0.7 |
| 氧化铜质量(g) |
8 |
8 |
8 |
8 |
上述设计方案的主要研究方法是__________________。
(6分)x气体可能由CH4、H2、CO中的一种或几种组成,某化学兴趣小组的同学利用如下装置进行实验验证该气体的组成。(碱石灰的主要成分为NaOH和CaO)
(1)写出CH4燃烧的化学反应方程式____。
(2)填写下列实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| 打开分液漏斗上端玻璃塞和下端活塞,____ |
若____ |
X气体为H2 |
| 若____ |
X气体为CO |
(3)若x气体燃烧后有水和二氧化碳生成,则x气体的组成可能为____。
(6分)根据下图回答问题。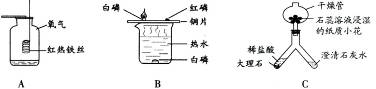
(1)写出实验A中反应的化学方程式_________。集气瓶中水的作用是__________。
(2)通过实验B可得出可燃物燃烧的两个条件是____、____。
(3)实验c中观察到的现象有:稀盐酸与大理石反应有气泡生成、____、____。
(5分)某化学小组的同学欲对某种塑料的组成进行分析研究(资料显示该塑料只含C、H两种元素),他们设计了如下图所示的实验装置。目的是通过测量有关数据,推算塑料组成元素的含量(图中字母A至G均表示装置序号)。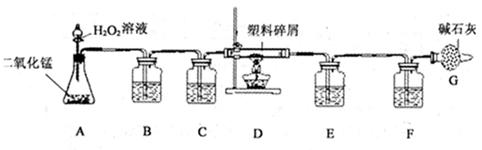
请根据实验装置,回答下列问题:
(1) A装置制取的氧气中混有少量CO2和水蒸气,为使D装置中塑料试样在纯氧中燃烧,用于除去CO2的装置为(填装置序号);反应的化学方程式为。
(2)气体的吸收装置E中的试剂为。
(3)碱石灰的成分是氢氧化钠和氧化钙,G装置的作用是。