下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法中正确的是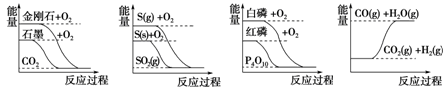
| A.石墨转变为金刚石是吸热反应 |
| B.S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2 |
| C.白磷比红磷稳定 |
D.CO(g)+H2O(g)  CO2(g)+H2(g) ΔH>0 CO2(g)+H2(g) ΔH>0 |
有机物A的分子式为C11H16,它不能因反应而使溴水褪色,但能使酸性KMnO4溶液褪色,经测定数据表明,分子中除含苯环外不再含有其他环状结构,且苯环上只有一个侧链,符合此条件的烃的结构有
| A.5种 | B.6种 | C.7种 | D.8种 |
化合物M叫假蜜环菌甲素(如右图), 它是香豆素类天然化合物。对M性质叙述正确的是
它是香豆素类天然化合物。对M性质叙述正确的是
| A.M能与FeCl3发生反应,不能与CH3COOH发生反应 |
| B.M与Br2只能发生取代反应,不能发生加成反应 |
| C.1molM最多可消阿耗3mol NaOH |
| D.1molM在催化剂作用下最多能与4molH2发生加成反应 |
下列物质中,既能与盐酸反应,又能与KOH溶液反应的是
①NaHCO3②AgNO3③(NH4)2S
④HOOC-COONa⑤ ⑥
⑥
| A.全部 | B.①②④⑤⑥ | C.②③④⑤⑥ | D.②④⑤⑥ |
提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法正确的是
| 不纯物质 |
除杂试剂 |
分离方法 |
|
| A |
乙酸乙酯(乙酸) |
饱和碳酸钠溶液 |
过滤 |
| B |
乙烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| C |
苯(Br2) |
KOH溶液 |
分液 |
| D |
苯(苯酚) |
浓溴水 |
过滤 |
下列说法正确的是
| A.汽油是纯净物,乙醇汽油是混合物 |
| B.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是蛋白质和烃 |
| C.糖类、蛋白质在一定条件下都能发生水解反应 |
| D.乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键 |