某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
| A.m=2 | B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 | D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实 验 操 作 |
实验现象 |
结论 |
| A |
向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 |
均有固体析出 |
蛋白质均发生变性 |
| B |
将一定量的NaNO3和KCl混合液加热浓缩至有固体析出,过滤 |
得到白色晶体 |
白色晶体为KNO3 |
| C |
向某FeCl2溶液中,加入Na2O2粉末 |
得红褐色沉淀 |
原FeCl2已氧化变质 |
| D |
向浓度均为0.1 mol/L NaCl和NaI混合溶液中滴加少量AgNO3溶液 |
出现黄色沉淀 |
Ksp(AgCl) > Ksp(AgI) |
【原创】某电化学装置工作原理如图。下列有关说法正确的是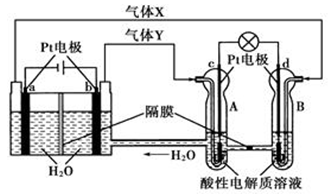
| A.气体X为O2 |
| B.c电极为负极,发生的电极反应式为H2—2e-=2H+ |
| C.一段时间后A处PH降低 |
| D.当有0.4mol电子转移时,在b极上生成标准状况下气体2.24L。 |
下列说法正确的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO )+c(HCO
)+c(HCO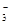 )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④已知:Ksp(AgCl)=1.8xl0-10, Ksp(A92Cr2O4)=2.0×l0-12,则Ag2CrO4的溶解度小于AgCl
| A.①④ | B.②③ | C.①③ | D.②④ |
短周期元素W、X、Y、Z的原子序数依次增大,且原子最外层电子数之和为14。W的原子半径比X的大,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最高的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法正确的是
| A.元素X的最高价氧化物对应的水化物的酸性比Z的弱 |
| B.元素Y、Z的简单离子的电子层结构相同 |
| C.元素W与Z形成的化合物为共价化合物 |
| D.原子半径由大到小的顺序为:r(Z)>r(Y)>r (W) |
【改编】N2O4 2NO2,某温度下相互转化时的量变关系如图所示。下列说法正确的是
2NO2,某温度下相互转化时的量变关系如图所示。下列说法正确的是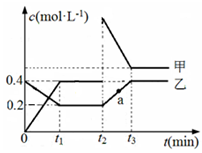
| A.0~t1时间内v(N2O4)=0.2mol/(L•min) |
| B.a点时化学平衡向逆反应方向移动 |
| C.t1~t2时间内反应v正(乙)<v逆(甲) |
| D.反应进行到t2时刻,改变的条件可能是加入了催化剂 |