乙苯催化脱氢制苯乙烯反应:
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612[ |
436 |
计算上述反应的△H=____________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________(用含α等字母的代数式表示)。
如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL。
试求:(1)写出①、②的电极反应式; ______________ _______________
(2)通过计算确定通电前A池中原混合溶液Cu2+的浓度是。
碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-)。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 |
体积V/mL |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中VxmL,理由是。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s)ΔH
2LiI(s)ΔH
已知:①4Li(s)+O2(g) 2Li2O(s)ΔH1
2Li2O(s)ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2
则电池反应的ΔH=;碘电极作为该电池的极。
(16 分) (1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:。
(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g)△H1="-394" kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2="-572" kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2600kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1 mol C2H2 (g)反应的焓变:
△H=_____。
(3) 4.6 g酒精和一定量的氧气混合点燃,恰好完全燃烧,生成5.4 g水和4.48 L CO2(产物均在标准状况下测定),并放出140 kJ热量,写出表示酒精燃烧热的热化学方程式为。
(4)中和热是指酸跟碱发生中和反应生成l mol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题: 
①从实验装置上看,图中尚缺少的一种玻璃用品是___________,烧杯间填满碎塑料泡沫的作用是_________________。
②实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是所求中和热的数值会________(填“相等”或“不相等”)。
已知有一种节能的氯碱工业新工艺,将电解池和燃料电池相组合,相关流程如下图所示(电极未标出):回答下列有关问题: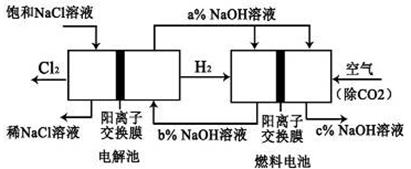
(1)电解池的阴极反应式为 _____________________________________
(2)通入空气的电极为_______________(“正极”或“负极”)
燃料电池中阳离子的移动方向___________(“从左向右”或“从右向左”)。
(3)电解池中产生2 mol Cl2,理论上燃料电池中消耗_____ mol O2。
(4)a、b、c的大小关系为:__________。
(10分)(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线图所示。由图中数据分析,该反应的化学方程式为:______________________________________________________
反应开始至2 min,Z的平均反应速率为__________________。
(2)不同时间测得以下反应速率:①v(X)=0.075mol/(L·min)
②v(Y)=0.001mol/(L·s)③v(Z)=0.06mol/(L·min)
速率由大到小关系正确为:(填编号)
(3)可逆反应:
aA(g)+bB(g)  cC(g)+dD(g)的v-t图像如图所示:
cC(g)+dD(g)的v-t图像如图所示:
①其阴影面积表示的是________________________________
②若其他条件都不变,只是在反应前加入合适的催化剂,则阴影面积将________(填变大、不变或变小)