电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
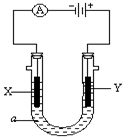
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 ,电极反应式是 。
(3)此装置若是在某金属上电镀铜,则①X电极的材料是 ,②Y电极的材料是 ,电解液a选用 溶液
随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“维生素”)不足引起的。
(2)微量元素与人体健康密切相关,若膳食结构不合理,摄入某种微量元素不足,就会引起某些疾病,例如身材矮小,腰背弯曲可能是由于缺________,_________元素是合成甲状腺激素的重要原料;人体铁元素摄入量不足可能会导致_________。
2008年春节后汽车销售形势喜人,但是汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式:。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是(用简单的语言表达)。
油脂在人体中消化过程实质上是在酶的催化作用下,高级脂肪酸甘油脂发生水解,生成了和。
肉桂醛(C9H8O)是一种常用香精,在食品、医药化工等方面都有应用。肉桂醛与其他有机物具有如下转化关系,其中A为一氯代烃。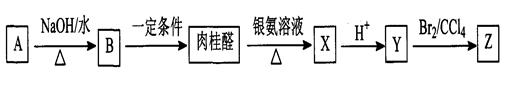
(1)肉桂醛是苯的一取代物,与H2加成的产物中没有支链,肉桂醛结构简式是_______。
(2)反应A→B的化学方程式是________________________________。
(3)Z不能发生的反应类型是(填字母)___________。
a. 取代反应 b. 加聚反应 c. 加成反应 d. 消去反应
(4)Y与乙醇在一定条件下反应的化学方程式是
_____________________________________________________。
(5)写出符合下列条件的Y的一种同分异构体的结构简式:
______________________________________________________。
①属于酯类②苯环上只有一个取代基③能发生银镜反应。
有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是90,则A的分子式是_______________。
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是__________________。
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A 的结构简式是_________________________________。
(4)0.1 mol A与足量Na反应,在标准状况下产生H2的体积是__________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是________________________________________。