离子方程式H++OH- = H2O可以表示的反应是
| A.所有酸和碱之间的中和反应 |
| B.所有强酸和强碱之间的中和反应 |
| C.所有可溶性酸和可溶性碱之间的中和反应 |
| D.强酸溶液与强碱溶液生成可溶性盐和水的反应 |
某溶液中可能含有SiO32—、OH—、CO32—、SO42—、AlO2—、HCO3—、Na+、Mg2+、Fe3+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是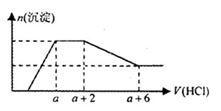
| A.原溶液中一定含有Na2SO4 |
| B.反应最后形成的溶液中的溶质只有NaCl |
| C.原溶液中含有CO32- 与AlO2-的物质的量之比为1∶2 |
| D.原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2— |
需要配制500 mL 0.5 mol/L 氢氧化钠溶液,经测定试剂氢氧化钠溶液的浓度为0.45 mol/L 。可能原因是
| A.定容时溶液没有冷却至室温 |
| B.容量瓶没有烘干 |
| C.称量氢氧化钠固体时砝码放反了 |
| D.定容时仰视读数 |
下列说法正确的数目是
①二氧化硅具有良好的半导体特性,故而可用作光导纤维
②硅酸钠为盐,非碱类物质,故可用玻璃瓶盛装
③高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,说明硅酸酸性强于碳酸
④硅溶于氢氧化钠溶液,只有水作氧化剂,NaOH既非氧化剂也非还原剂
| A.1 | B.2 | C.3 | D.4 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1.0 L 1.0 mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B.56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
| C.标准状况下,22.4 L氨水含有NA个NH3分子 |
| D.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
下列离子或分子在指定介质中能大量共存的是
| A.硝酸亚铁溶液中:Al3+、H+、SO42-、Cl-、CO32- |
| B.透明溶液中:Cu2+、Fe3+、NH4+、NO3-、SO42- |
| C.强酸性溶液中:CH3CH2OH、Mg2+、MnO4-、SiO32- |
| D.含有大量ClO-的溶液中:K+、OH-、I-、SO32- |