(1)填写下列实验操作主要仪器名称:
浓缩CuSO4溶液所用容器是___ ____;
分离酒精和水的受热容器是____________ _______;
石油的蒸馏装置中通冷却水的仪器是____ ____;
接受馏出产品的仪器是____ ______。
(2)填写下列实验过程的主要操作或方法的名称:
分离汽油和水的混合物 ;
提取碘水中的碘 ;
去除水中的沙子 ;
除去淀粉溶液里混有的氯化钾 ;
鉴别Fe(OH)3溶胶和碘酒溶液 。
(3)用自来水配制的AgNO3溶液,会出现浑浊。过滤出沉淀,向其中加入稀HNO3沉淀不溶解,请你分析该沉淀的成份是____________,说明自来水中含有_____________离子(用化学式符号填写),该反应的离子方程式为 。
卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: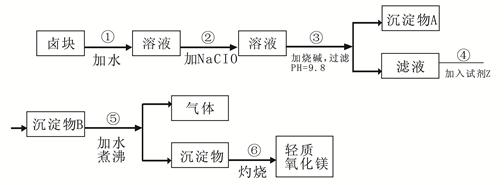
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
表2化学试剂价格表
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2 ,30%) |
2400 |
| 烧碱(含98% NaOH) |
2100 |
| 纯碱(含99.5% Na2CO3) |
600 |
(1)在步骤②中加入漂液而不是双氧水其原因是。
写出加入NaClO发生反应的离子方程式。
(2)在步骤③中控制pH=9.8,其目的是。
(3)沉淀物A的成分为,试剂Z应该是。
(4)在步骤⑤中发生反应的化学方程式是。
(5)若在实验室中完成步骤⑥,则沉淀物必需在(填仪器名称)中灼烧。
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3 (l)+ H2O (l)+ CO2 (g)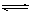 (NH4)2CO3 (aq)△H1
(NH4)2CO3 (aq)△H1
反应Ⅱ:NH3 (l)+ H2O (l)+ CO2 (g)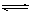 NH4HCO3 (aq)△H2
NH4HCO3 (aq)△H2
反应Ⅲ:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g)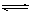 2NH4HCO3 (aq)△H3
2NH4HCO3 (aq)△H3
请回答下列问题:
(1)△H1与△H2、△H3之间的关系是:△H3= 。
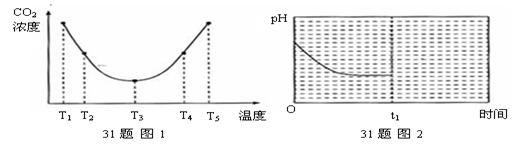
(2)为研究温度对(NH4)2CO3捕获CO2气体效率的影响,在温度为T1、T2、T3、T4、T5的条件下,将等体积等浓度的(NH4)2CO3溶液分别置于等体积的密闭容器中,并充入等量的CO2气体,经过相同时间测得容器中CO2气体的浓度,得趋势图(下图1)。则:
①△H3______0 (填“>”、“=”或“<”)。
②温度高于T3,不利于CO2的捕获,原因是 。
③反应Ⅲ在温度为K1时,溶液pH随时间变化的趋势曲线如下图2所示。当时间到达t1时,将该反应体系温度迅速上升到K2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化趋势曲线。
|
在250℃时,吲哚与乙醇酸在碱的存在下反应,可以得到植物生长素吲哚乙酸:
由邻硝基甲苯1和草酸二乙酯2反应最终可合成吲哚5(Et表示CH3CH2—):
乙醇酸的合成: 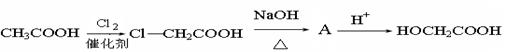
(1)物质4的分子式是,吲哚乙酸的含氧官能团的名称是;
(2)邻硝基甲苯与草酸二乙酯反应除生成物质3外,还有另外一种有机物是,
该反应的反应类型是;
(3)生成物质A的化学方程式是;
(4)已知乳酸的结构简式为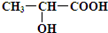 ,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件):;
,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件):;
(5)邻硝基甲苯苯环上含有氨基的同分异构体有多种,请写出其中一种的结构简式。
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下: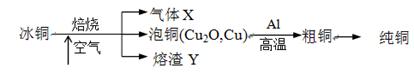
请回答下列问题:
(1)气体X是。
(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②装置C的作用是________________。
③在点燃D处的酒精灯前,应进行的操作是__________________。

(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。
限选试剂: 3 mol·L-1H2SO4、6 mol·L-1HNO3、3% H2O2、0.01 mol·L-1KMnO4、20% KSCN。
。
(4)写出泡铜冶炼粗铜反应的化学方程式。
(5)根据限选材料画出用粗铜提炼纯铜的装置图,并进行必要的标注。
限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是。
(2)步骤②中,为提高浸出率,可采取的措施有。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)从水浸后的滤液中得到K2SO4晶体的方法是。
(4)步骤③电解的化学方程式是,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为吨(列出计算表达式)。