根据以下几个反应:
①Cl2+2KI 2KCl+I2 ②2FeCl2+Cl2
2KCl+I2 ②2FeCl2+Cl2 2FeCl3
2FeCl3
③2FeCl3+2KI 2FeCl2+2KCl+I2 ④I2+SO2+2H2O
2FeCl2+2KCl+I2 ④I2+SO2+2H2O H2SO4+2HI
H2SO4+2HI
判断还原性由强到弱的顺序是
| A.I->Fe2+>SO2 >Cl- | B.SO2>Fe2+>I-> Cl- |
| C.SO2>I ->Fe2+> Cl- | D.Fe2+>I->Cl->SO2 |
下列说法正确的是
| A.离子晶体的晶格能:Mg0> KCI> NaCl |
| B.“冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量高 |
| C.对于反应2H202=2H20+02↑,加入Mn02或升高温度都能加快02的生成速率 |
| D.对羟基苯甲醛的沸点大于邻羟基苯甲醛,原因是后者分子之间存在氢键 |
下列图示与对应的叙述相符合的是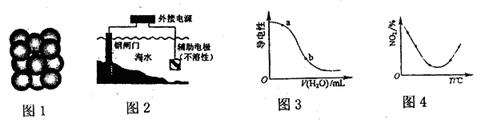
| A.图l为某金属单质晶体中原子的堆积方式,则其晶胞构型为体心立方 |
| B.图2为钢闸门的防腐原理示意图,则钢闸门应与电源的正极相连 |
| C.图3表示CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| D.图4表示在容积相同的恒容密闭容器中,等量的N02在不同温度下反应: |
2N02(g) N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O
N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O
下列有关实验原理、方法和结论都正确的是
| A.用HN02溶液作导电性实验,灯光较暗,说明HN02是弱电解质 |
| B.在滴有酚酞的Na2C03溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2C03溶液中存在水解平衡 |
| C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大 |
| D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来 |
下列说法正确的是
| A.将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3 |
| B.25oC时CH3COONa溶液的Kw大于100OC时CH3COONa溶液的Kw |
| C.100OC时,将PH=2的盐酸与PH=12的NaOH溶液等体积混合,溶液呈中性 |
| D.一般而言,弱电解质的浓度越大,其电离度越小,电离常数也越小 |
下列关于化学反应的描述中正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.反应4Fe(OH)2(s) +02(g)+2H20(l)=4Fe(OH)3(S)的△H>O |
C.已知①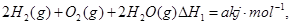 ② 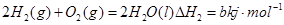 ,则a<b ,则a<b |
| D.CO(g)的标准燃烧是283.0kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)△H=+566.0kJ·mol-1 |