天然气与煤炭、石油等能源相比具有使用安全、热值高、洁净等优势。天然气的主要成分是甲烷,此外还含有少量的乙烷、丙烷、二氧化碳、一氧化碳等。
(1)天然气属于 (填“混合物”或“纯净物”)。
(2)甲烷燃烧时发生的化学反应的微观示意图如下图所示。其中, 表示碳原子,
表示碳原子, 表示氧原子,
表示氧原子,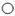 表示氢原子。
表示氢原子。
A B C D
① A中分子为甲烷分子,1个甲烷分子中含有 个原子。
② 甲烷中碳、氢元素质量比为 。
③ 根据图示信息,写出甲烷燃烧反应的文字表达式 。
(3)甲烷不仅可以作为燃料,还可以用于制造多种物质。例如,在高温条件下,甲烷可以生成碳和氢气,该反应的文字表达式为:甲烷 碳 + 氢气,基本反应类型为 。
碳 + 氢气,基本反应类型为 。
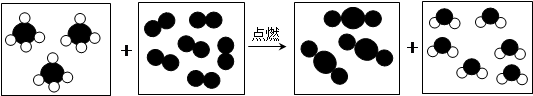
有A、B、C、D、E五种物质,在常温下A、B是液体,C是气体,D是黑色固体,E是一种能使澄清石灰水变浑浊的气体;A和B的组成元素相同,图中“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去。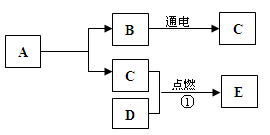
(1)写出A、C、E的化学式:A,B,E;
(2)A和C内含有的同一种元素名称是;
(3)写出反应①的化学方程式。
下图所示是铁丝(图1)和硫(图2)在氧气中燃烧的实验,试回答下列问题:
(1)做铁丝在氧气中燃烧的实验时,铁丝的一端要系一根火柴的原因是,集气瓶底部铺一层水的目的是。
(2)硫在氧气中剧烈燃烧,产生火焰;图1和图2在集气瓶底部铺一层水的目的(“相同”或“不相同”)。
水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任。
(1)下列“水”属于纯净物的是(填序号)。
A.蒸馏水B.河水C.自来水
(2)用图甲装置进行电解水的实验,往水中加入氢氧化钠的目的是,实验时a中收集到的气体是,b中收集到的气体是,用检验,看到的现象是;a和b玻璃管中产生的气体体积比约是,该实验说明水是由组成的。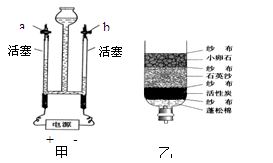
(3)云南水资源丰富,但分布不均。有些村民用地下水作为生活用水,人们常用检验地下水是硬水还是软水;生活中可用的方法降低水的硬度;某同学自制右图乙所示简易净水器,图中活性炭的主要作用是。
(4)请举一例生活中节约用水的具体措施。
)现有①氮气 ②氧气 ③稀有气体 ④二氧化碳四种物质,请按下列要求将序号填入空格内:
(1)占空气总体积21%的气体是_________;
(2)可导致温室效应的气体是_________;
(3)可制多种电光源的气体是;
(4)可制氮肥的气体是_________;
(1)掌握化学用语是学习化学的关键。用化学用语填空:
①2个硫原子;②4个氢氧根离子;③3个氮分子;
④氧化镁中镁元素的化合价;⑤氩气。
(2)下图是某化学反应前后的微观模拟图,请根据图示回答: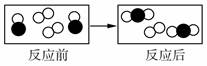
①该化学反应中,参加反应的“ ”和“
”和“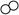 ”与反应后生成的“
”与反应后生成的“ ”各粒子间的个数比为;
”各粒子间的个数比为;
②该反应的基本反应类型为;
③请用分子和原子的观点来解释化学反应的实质。