小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究。

【查阅资料】CaO+H2O→Ca(OH)2。
(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如右图所示的装置进行实验,打开分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是 。由此可知养鱼师傅向鱼塘中撒过氧化钙的目的是 ,仪器a的名称 。
(2)通过请教老师小强得知过氧化钙与过量水反应除生成上述气体外还会生成一种含有钙元素的化合物。开始小强假设该产物为CaO,但通过思考他很快否定了原先的假设,并重新假设生成的含钙产物为Ca(OH)2。
请解释小强否定原假设建立新假设的理由: 。
(3)小强通过实验证明了过氧化钙与水反应的确有氢氧化钙生成,请写出过氧化钙和水反应的化学式表达式: 。
(4)小强在实验时观察到烧杯中有气泡产生,由此他还得出该反应 (填吸热或放热)
实验室有一瓶长期暴露在空气中的氢氧化钠固体,某兴趣小组的同学对该样品的成分及含量进行了探究。
【实验探究一】为得到纯净的氢氧化钠固体,并测定NaOH的纯度,设计的实验过程如下图。请回答下列问题: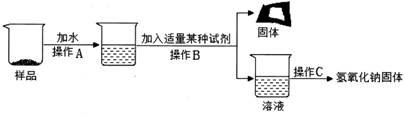
①长期暴露在空气中的氢氧化钠固体样品,所含杂质是(1),操作B中加入的试剂是(2);(以上填写化学式或物质名称均可)
②操作A、B 的名称分别为(3)、(4);
③若要测定该固体中NaOH的纯度,实验过程中一定还需用到的仪器是(5)。
【实验探究二】为了测定NaOH的纯度,小红同学设计如图装置(铁架台略去)。己知,碳酸氢钠溶液不吸收二氧化碳。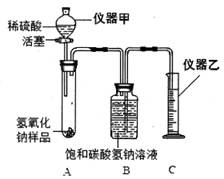
④写出指定仪器的名称:
甲(6)、乙(7);
⑤实验中取用样品质量要控制在一定范围内,如果样品用量过多,造成的后果是(8);
⑥取l0g样品进行实验,根据实验数据,通过计算可知产生了CO2 0.11g ,求原样品中NaOH的纯度,写出计算过程。
(9)【实验反思】
⑦利用该实验装置,若操作正确,装置气密性良好,测定的NaOH纯度也将(10)(填“偏大”或“偏小”),理由是(11)。
某化学兴趣小组在一次实验活动中发现钠能在二氧化碳中燃烧,他们对钠在二氧化碳气体中燃烧后生成的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3
假设3:。
设计实验方案,验证假设
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质是Na2O。 |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCL2 |
有白色沉淀生成 |
白色物质是Na2CO3 |
| ②静置片刻,取上层清液于试管中…… |
…… |
思考与交流:
(1)甲同学认为方案1得到的结论不正确,其理由是
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象。
实验操作:
实验现象:
(3)乙同学认为白色物质可能是NaOH,你填(同意或不同意)该同学的观点,
并简述理由:
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:。
如图所示,某实验小组进行以下实验: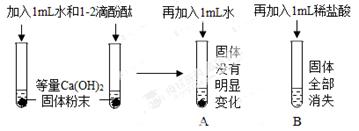
(1)上述实验进行对比的目的是 _________ .
(2)实验后,将A、B两试管中的溶液倒入同一个洁净的烧杯中,溶液无色.再向其中加入一定量的碳酸钠溶液(提示:CaCl2+Na2CO3═CaCO3↓+2NaCl),所得混合物中溶液的溶质成分有四种情况,请补充完整(酚酞省略不写):①NaCl;② ________ ;③ _______ ;④ _________ .若该混合物中溶液无色,选用一种试剂即可确定溶质成分是哪种情况,写出所加试剂,预期现象和结论.
在学习金属的性质时,老师拿来了三种外观酷似金、银、铜的样品,同学们对样品进行以下探究:
①用锤子砸“金”,样品粉碎;
②加入稀盐酸:“金”和“铜”没有现象,“银”有大量气泡产生;
③测定密度:“金”4.9g/cm3,“银”7.1g/cm3,“铜”7.5g/cm3.
④查阅几种常见金属的密度,如下表:
| 金属 |
金 |
银 |
铜 |
铁 |
锌 |
| 密度(g/cm3) |
19.3 |
10.5 |
8.9 |
7.9 |
7.1 |
(1)根据以上探究,确定“金”是假的理由有哪些?推测“银”可能是什么金属,依据是什么?
(2)已知“铜”只有表面镀了一薄层致密的铜,内部是锌.若不粉碎“铜”,选用稀硫酸和锌粉,测定一定质量“铜”样品中铜的质量,设计实验方案.
某教师设计的创新实验装置图如下,请完成下列探究: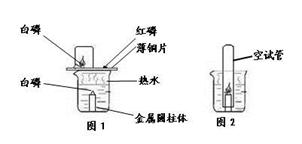
【实验内容】在500 mL的烧杯中放一金属圆柱体,注入400 mL热水,在圆柱体上放一小块白磷。在烧杯上盖一薄铜片,铜片的一端放一小堆红磷,另一端放一小块用滤纸吸干水后的白磷,观察。
【实验现象】铜片上的白磷燃烧,红磷不燃烧,能说明的燃烧条件是;铜片上的白磷燃烧后,用一小烧杯罩在白磷上方,燃烧就停止,说明灭火的可以采用原理;取下铜片后,用一支空试管向下罩住水中的金属圆柱体,水中白磷燃烧,其化学方程式是;
【分析讨论】(1)铜片上放一小块白磷时,用滤纸将其表面的水吸干,原因是。
(2)铜片上的白磷燃烧后,用一小烧杯罩在白磷上方,最好在烧杯内壁沾一些水,其原因是。
【教师反思】教材P124[实验7-1]是一个对照鲜明,现象明显的探究实验。但是,该实验也存在不足。为了克服不足,在教学中,我对该实验进行的改进,改进后的优点有(写出一条即可).