某校化学兴趣小组的同学对加热氯酸钾与二氧化锰的混合物制取氧气实验中“二氧化锰充当的角色”进行了探究,请你参与。
资料:I、氯酸钾受热分解产生氯化钾和氧气。
II、氯化钾易溶于水,二氧化锰难溶于水。
探究活动一:二氧化锰能否改变氯酸钾受热分解的速率
(1)取适量的氯酸钾于试管中,将氯酸钾加热至熔化,将带火星木条伸入试管中,较长的时间后,木条复燃,说明氯酸钾受热能产生氧气,但是反应速率较 (“快” 或“慢”);
(2)取适量的二氧化锰于试管中,加热二氧化锰,将带火星木条伸入试管中,木条没有复燃,说明二氧化锰受热 (填“能”或“不能”)产生氧气。
(3)取氯酸钾和少量二氧化锰的混合物于试管中,加热混合物,将带火星木条伸入试管中,木条迅速复燃,说明二氧化锰能 (填“加快”或“减慢”)氯酸钾受热分解的速率。
探究活动二:氯酸钾受热分解前后二氧化锰质量、化学性质是否改变
(4)为了验证氯酸钾受热分解前后二氧化锰质量是否改变,某同学设计方案如下:

①溶解剩余固体的水要足量,目的是使 (填物质的化学式)全部溶解。
②组装过滤器时,滤纸紧贴漏斗内壁,可以使过滤速率 (填“快”或“慢”)一些,滤纸边缘要 (填“高于”或“低于”)漏斗边缘。 过滤时,要用 (填仪器名称)引流,防止浊液洒出、冲破滤纸;漏斗中液体的液面要 (填“高于”或“低于”)滤纸边缘,防止滤液浑浊;漏斗末端应该紧贴烧杯内壁,目的是 。
ƒ滤渣经过洗涤、烘干后称量,发现两次称量的二氧化锰的质量相等。
(5)请写出验证“氯酸钾受热分解前后二氧化锰的化学性质也不变”的操作和现象:_______________。
【得出结论】综合探究活动一、二的结果可知:加热氯酸钾与二氧化锰的混合物制取氧气实验中“二氧化锰充当 ”(“反应物”、“催化剂”或“生成物”)。
【反思与交流】上述实验中的滤渣若没有洗涤就进行称量,称量的质量会 (“偏大”、“不变”或“偏小”) 。
日常生活中使用的塑料袋有两种,一种是用聚乙烯制成的,另一种是用聚氯乙烯制成的。通过查阅资料知:聚乙烯完全燃烧生成CO2和H2O,而聚氯乙烯完全燃烧除生成CO2和H2O外,还有刺激性气味的气体产生,该气体极易溶于水生成盐酸,则该气体是________________。
(1)鉴别这两种塑料袋最简单的方法是________________________________。
(2)现用如图所示的实验来探究塑料燃烧的产物。实验时,若B、C两瓶都观察到明显现象,则B瓶中的现象是_____________,C瓶中的现象是___________,由此可判断A瓶中燃烧的是_____________________。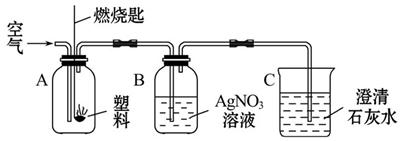
学习氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞溶液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞溶液变红色。
【提出猜想】猜想①:可能是H2O;
猜想②:可能是Na+;
猜想③:可能是OH-。
【实验验证】
| 实验操作 |
实验现象 |
结论 |
| ①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞溶液,振荡 |
试管内溶液仍为无色 |
水分子不能使无色酚酞溶液变红色 |
| ②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞溶液,振荡 |
||
| ③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞溶液,振荡 |
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是__________________________。
实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据要求回答问题:
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有_________(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如图装置(脱脂棉团因喷有稀氢氧化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象是__________________,发生反应的化学方程式为_____________。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。据此现象可推知浓硝酸具有_________(填一条化学性质)的性质。
(3)通过上述两个实验可知,实验室应如何保存浓硝酸?__________________。
在两支试管中各加入2 mL水,然后分别加入1~2小粒碘或高锰酸钾,振荡,观察现象;然后再向两支试管中分别加1 mL汽油,振荡,静置,观察现象。记录如表所示:
| 溶剂 |
溶质 |
现象 |
| 先加水 |
碘 |
底部仍有碘固体,液体呈浅黄色 |
| 先加水 |
高锰酸钾 |
底部无固体,溶液呈深紫色 |
| 再加汽油 |
碘 |
分层,上层呈深紫色,下层近无色,底部无固体 |
| 再加汽油 |
高锰酸钾 |
分层,上层无色,下层呈深紫色,底部无固体 |
请回答:
(1)加入汽油后,投入碘的试管的上层液体名称是_________;投入高锰酸钾的试管的下层液体的名称是_____________________。
(2)从实验现象可以归纳:碘的溶解性为______________,高锰酸钾的溶解性为____________________。
(3)在科学研究中,若将大量水中溶解的少量碘“富集”起来,你认为可以采取的方法是__________________。
铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
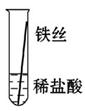
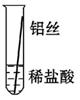
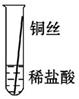
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
| 操作 |
 |
 |
 |
根据现象得出金属活动性顺序 |
| 片刻后现象 |
有少量气泡 |
无气泡 |
无气泡 |
Fe>Al,Fe>Cu |
| 几分钟后现象 |
有少量气泡 |
有大量气泡 |
无气泡 |
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是________。
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
| 操作 |
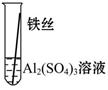 |
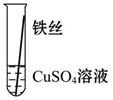 |
根据现象得出金属活动性顺序 |
| 现象 |
无明显现象 |
Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式_________________。
【拓展迁移】(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为________________。
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序________________。