下列说法正确的是
| A.在海轮船壳上镶入锌块保护海轮,利用的是牺牲阳极的阴极保护法 |
| B.加入合适的催化剂,能降低反应活化能,从而改变反应的焓变 |
| C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| D.稀醋酸中加入少量CH3COONa固体,醋酸的电离程度减小,c(CH3COO-)增大 |
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是( )
①原溶液中的Br-一定被氧化;
②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |
某学生用NaHCO3和KHCO3组成的某固体混合物进行实验,测得如下表数据(盐酸的物质的量浓度相等):
| 实验编号 |
① |
② |
③ |
| 盐酸体积 |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2g |
16.56g |
27.6g |
| V(CO2)(标准状况) |
2.24L |
3.36L |
3.36L |
分析表中数据,下列说法不正确的是( )
A.由①可以计算出盐酸的物质的量浓度
B.由②、③可知:混合物质量增加,气体体积没有变化,说明盐酸已经反应完全
C.由①、②可知:①中的固体不足而完全反应
D.由①可以计算出混合物的NaHCO3的质量分数
下列叙述正确的是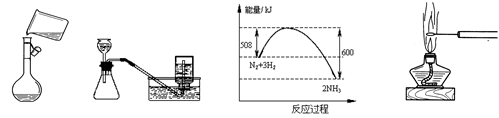
图A图B图C图D
| A.图A是将溶解好的溶液转移到容量瓶中 |
| B.选择合适的试剂,用如图B所示装置可分别制取并收集少量H2、NO2和Cl2 |
| C.图C是N2与H2合成氨的能量变化曲线,可确定该反应1 mol N2和4 mol H2充分反应时放热一定小于92 kJ |
| D.如图D可观察KCl的焰色反应 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是
| A.1 mol NH5中含有5 NA个N—H键(NA表示阿伏加德罗常数) |
| B.NH5中既有共价键又有离子键 |
C.NH5的电子式为 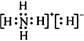 |
| D.它与水反应的离子方程式为NH4++ H-+ H2O = NH3·H2O + H2↑ |
设NA为阿伏加德罗常数,下列叙述正确的是
| A.27g铝的原子最外层电子总数为NA |
| B.2.8 g N2和2.8 g CO所含电子数均为1.4NA |
| C.1L0.1mol·L-1乙酸溶液中H+数为0.1NA |
| D.标准状况下,22.4L乙醇的分子数为NA |