利用右图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
 |
| A |
浓盐酸 |
MnO2 |
NaOH |
制氯气并吸收尾气 |
|
| B |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |
|
| C |
稀盐酸 |
Na2SO3 |
Ba(NO3)2溶液 |
SO2与可溶性钡盐均可生成白色沉淀 |
|
| D |
浓硝酸 |
Na2CO3 |
Na2SiO3溶液 |
酸性:硝酸>碳酸>硅酸 |
区分强电解质和弱电解质的依据是
| A.溶解度的大小 | B.属于离子化合物还是共价化合物 |
| C.在水溶液中是否存在电离平衡 | D.溶液导电性的强弱 |
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如右图所示。下列有关溶液中离子浓度关系叙述正确的是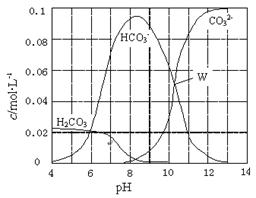
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 |
X产生氢气的体积比Y多 |
金属性:X>Y |
| B |
向滴有甲基橙的AgNO3溶液中滴加KCl溶液 |
溶液由红色变为黄色 |
KCl溶液具有碱性 |
| C |
在CuSO4溶液中加入KI溶液,再加入苯,振荡 |
有白色沉淀生成,苯层呈紫色 |
白色沉淀可能为CuI |
| D |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
右图是某同学设计的原电池装置,下列叙述中正确的是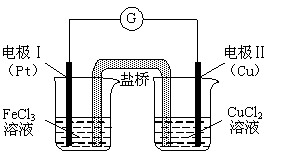
| A.电极Ⅰ上发生还原反应,作原电池的正极 |
| B.电极Ⅱ的电极反应式为:Cu2++2e-=" Cu" |
| C.该原电池的总反应为:2Fe3++Cu= Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |