用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表。
| 实验 编号 |
温度 |
初始pH |
0.1 mol/L草酸溶液/mL |
0.01mol/L KMnO4溶液 体积/mL |
蒸馏水 体积/mL |
待测数据(反应混合液褪色 时间/s) |
| ① |
常温 |
1 |
20 |
50 |
30 |
t1 |
| ② |
常温 |
2 |
20 |
50 |
30 |
t2 |
| ③ |
常温 |
2 |
40 |
a |
b |
t3 |
表中a、b的值分别为:a= 、b=_________
(2)该反应的离子方程式___________________________。
(3)若t1<t2,则根据实验①和②得到的结论是_____________________________。
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) |
预期实验结果和结论 |
| |
若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25. 00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是: __________________________;
实验中所需的定量仪器有 (填仪器名称)。
若用12 mol•L-1的浓盐酸配制0.10 mol•L-1的稀盐酸500 mL,回答下列问题:
(1)量取浓盐酸的体积为mL,如果实验室有5mL、10mL、50mL量筒,应选用mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(偏高、偏低、无影响)。
(2)配制时应选用的容量瓶规格为mL ,除容量瓶还需选用的仪器主要有、、和。
(3)配制时,将量取的浓盐酸沿烧杯内壁慢慢注入约100mL水里,并不断搅拌,目的是。
(4)将冷却后的上述溶液沿注入中,并用约50mL蒸馏水洗涤烧杯2~3次,转移摇匀。(填仪器)
(5)加水至距刻度线 处,改用(填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
处,改用(填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
(6)若实验遇下列情况,溶液的浓度是偏高 ,偏低还是不变?
,偏低还是不变?
| A.加水时越过刻度线______ | B.忘记将洗涤液加入容量瓶______ |
C.容量瓶内壁附有水珠而未干燥处理 |
D.溶解后没有冷却便进行定容 |
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,控制水浴温度在85oC左右,缓慢加热至反应完全,在试管
 C内得到环己烯粗品。
C内得到环己烯粗品。
①上面的制备装置中,还缺少的玻璃仪器是,导管B除 了导气外还具有的作用是。
了导气外还具有的作用是。
②试管C置于冰水浴中的目的是
 。
。
(2)制备精品(用下图)
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从口(填上或下)进入。蒸馏时要加入生石灰,目的是。
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇挥发随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是。
a.用酸性高锰酸钾溶液 b.用溴水 c.测定沸点
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
(1)写出该反应的反应方程式 。
。
(2)圆底烧瓶中盛装的是水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。
(1)实验室常用氯化铵固体跟氢氧化钙粉末混合加热制取氨气,该反应的化 学方程式为;
学方程式为;
(2)实验室制取氨气时应用的发生装置是下图中的(填标号),收集装置是
(填标号),选用该收集装置而不用图中另外两个收集装置的原因是。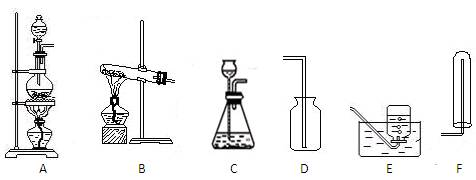
(3)实验室可用C装置制取的气体是(任答一种),该反应的化学方程式为。
为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
; _______________________________
(2)在(1)中应使用除杂试剂的化学式__________,在(2)中的操作名称是_______。
(3)从实验设计方案优化的角度分析步骤 ②和④可否颠倒_
②和④可否颠倒_ ___________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
___________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
步骤③和④可否颠倒___________。
(4)若先用盐酸再进行 操作⑤,将对实验
操作⑤,将对实验 结果产生影响,其原因是:
结果产生影响,其原因是:
(5)判断BaCl2已过量的方法是