焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH + SO2 = Na2SO3 + H2O……(a)
Na2SO3+ H2O + SO2 = 2NaHSO3 ……(b)
2NaHSO3 Na2S2O5 + H2O……(c)
Na2S2O5 + H2O……(c)
实验装置如下:

(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为 。
(2)题图-1装置中,导管X的作用是 。
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;
实验后期须保持温度在约80℃,可采用的加热方式为 。
(4)反应后的体系中有少量白色亚硫酸钠析出,参照题图-2溶解度曲线,除去其中亚硫酸钠固体的方法是 ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 。
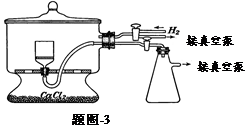
(5)用题图-3装置干燥Na2S2O5晶体时,通入H2的目的是 ;真空干燥的优点是 。
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。④ 。 ⑤ 。
⑥重复步骤①~⑤;根据相关记录数据计算出平均值。
(14分)氢化钙((CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。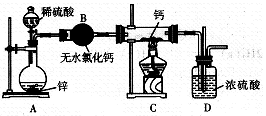
(1)装置B的作用是;装置D的作用是。
(2)利用图示实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活
塞,(请按正确的顺序填人下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是。
(4)甲同学设计了一个实验,测定上述实验中得到的氢化钙的纯度。请完善下列实验步骤:
①样品称量;
②加入溶液(填化学式),搅拌、过滤;
③(填操作名称);
④(填操作名称);
⑤称量碳酸钙。
(5)乙同学利用下图所示装置测定上述实验中得到的氢化钙的纯度。他称取46mg所制得的氢化钙样品,记录开始时注射器活栓停留在lO.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定)。试通过计算求样品中氢化钙的纯度:。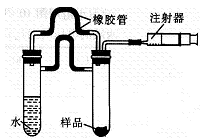
(6)请你再设计一种测定氢化钙纯度的方法:。
含苯酚的工业废水处理的流程图如图所示: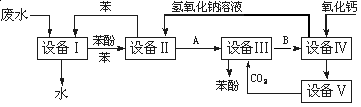
(1)上述流程里,设备Ⅰ中进行的是_________操作(填写操作名称)。实验室里这一步操作可以用____________(填写仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是_________。由设备Ⅲ进入设备Ⅳ的物质B是______________。(均填写物质的化学式)
(3)在设备Ⅲ中发生反应的化学方程式为:_______________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________操作(填写操作名称),可以使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、________、__________。(均填写物质的化学式)
实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: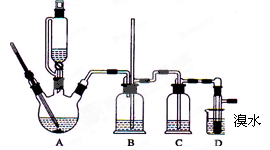
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g · cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-l30 |
9 |
-1l6 |
回答下列问题:
(1) 烧瓶A中发生的主要的反应方程式:。
(2) 安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞。请写出发生堵塞时瓶B中的现象:。
(3) 在装置C中应加入(填字母) ,其目的是______________________
A.水 B.浓硫酸 C.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用洗涤除去。(填字母)
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(5)若产物中有少量副产物乙醚,可用的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是。
(16分)某化学研究小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,在实验室中按以下步骤进行实验:
①称取a g样品,置于烧杯中;
②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色,冷却至室温后,称量;
⑦…… 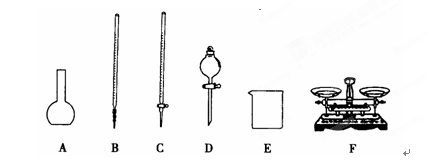
请根据上面的叙述回答下列问题:
(1)上图所给仪器中,实验步骤①②③中必须用到的仪器是E和_______ (填仪器序号)。还缺少的主要仪器名称是
(2)步骤④中所发生反应的离子方程式为
(3)步骤⑤中洗涤沉淀的操作是:,检验沉淀是否洗净,应向洗涤液中加入几滴(填写序号)。
①KSCN溶液②NaOH溶液③AgNO3溶液④酚酞试液
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,实验至少需重复加热一次的原因是;若m1与m2差值较大,其原因可能是①第一次加热,
②第二次加热。(各答一种情况即可)。
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为。
根据下图回答问题: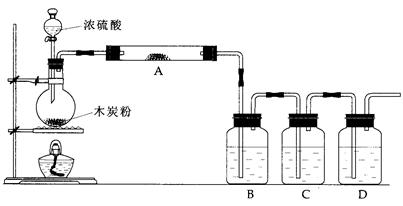
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。_____________________。
(2)写出浓硫酸和木碳粉在加热条件下发生反应的化学方程式:_____________
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂和作用是____________。 B中加入的试剂和作用是_______________。
D中加入的试剂和作用是_______________。
(4)实验时,C中应观察到的现象是___________________________________。