钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有 Ti和
Ti和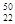 Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
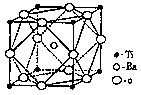
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是
(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
| A.苯与B3N3H6互为等电子体 |
| B.甲醛、苯分子中碳原子均采用sp2杂化 |
| C.苯、二氧化碳是非极性分子,水和甲醛是极性分子 |
| D.水的沸点比甲醛高得多,是因为水分子间能形成氢键 |
在某条件下,容器中有如下平衡反应:A+4B 2C+D,正反应为放热反应。此时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。
2C+D,正反应为放热反应。此时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a的取值范围应是_______(用a和d的关系式表示)。
(2)如果要使本反应重新建立的平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是_______(从下列给出的选项中选择)。
A.升高反应温度
B.增大反应容器内的压强
C.增大反应容器的容积
D.降低反应温度
E.减小反应容器内的压强
F.减小反应容器的容积
气态可逆反应:mA(g)+nB(g) pC(g)+qD(g),符合图2-31。
pC(g)+qD(g),符合图2-31。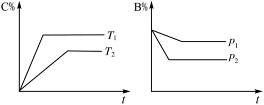
图2-31
试用“>”或“<”填(1)~(4)题。
(1)温度T1_________T2。
(2)压强p1_________p2。
(3)m+n_________p+q。
(4)正反应为________(填“放热”或“吸热”)反应。
牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡,向右为脱矿过程,向左为矿化过程:Ca5(PO4)3OH(s) 5Ca2++3
5Ca2++3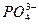 +OH-
+OH-
(1)人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是____
_______________________________________________________________________________。
(2)Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示,当牙膏中配有氟化物添加剂后能够防止龋齿的原因是___________________________________。
(3)根据以上原理,请提出一种其他促进矿化的方法________________________________。
某化学反应2A(g) B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号时间 |
0 |
2 |
3 |
4 |
| 800 |
℃ |
800 |
℃ |
|
| 1 |
1.0 |
c2 |
c3 |
1.0 |
| 10 |
0.80 |
0.60 |
0.92 |
0.20 |
| 20 |
0.67 |
0.50 |
0.75 |
0.20 |
| 30 |
0.57 |
0.50 |
0.63 |
0.20 |
| 40 |
0.50 |
0.50 |
0.60 |
0.20 |
| 50 |
0.50 |
0.50 |
0.60 |
0.20 |
| 60 |
0.50 |
0.50 |
0.60 |
0.20 |
(1)实验1中,反应在10至20分钟内平均化学反应速率为v(A)=______________。
(2)实验2中,A的初始浓度c2=______________mol·L-1,反应经20 min就达到平衡,可推测实验2中隐含的条件可能是_______________。
(3)若实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3______________v1(填“<”“>”或“=”=,且c3______________(填“<”“>”或“=”=1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应的正反应是______________(填“吸热”或“放热”反应)。理由是__________________________________________________________________。
在一定条件下,可逆反应mA+nB pC达到平衡,根据以下要求填空:
pC达到平衡,根据以下要求填空:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是_______
______________________________________________。
(2)A、C是气体,增加B的量,平衡不移动,则B为_____________________________态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向____________移动。