计算题(要写计算过程)
已知反应:Ca(OH)2+2NH4Cl  CaCl2 +2NH3↑+2H2O,现有7.4g Ca(OH)2与足量的NH4Cl充分反应。求
CaCl2 +2NH3↑+2H2O,现有7.4g Ca(OH)2与足量的NH4Cl充分反应。求
(1)生成的NH3在标准状况时的体积为多少?
(2)将所得NH3气体溶于100g水中,若所得氨水的密度为0.8g/mL,则该氨水的物质的量浓度为多少?(结果保留两位小数)
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
| Ⅰ |
7.4 |
40.00 |
1.68 |
| Ⅱ |
14.8 |
40.00 |
3.36 |
| Ⅲ |
22.2 |
40.00 |
1.12 |
| Ⅳ |
37.0 |
40.00 |
0.00 |
(1)写出实验过程中有关的离子方程式。
(2)由表格数据直接推测标准状况下3.7 g样品进行同样实验时,生成氨气的体积为多少升?
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓,度应选择第_________组数据,由此求得NaOH溶液的物质的量浓度为多少?
某空气污染监测仪是根据SO2和Br2的定量反应来测定空气中SO2含量的。参加反应的溴,来自一个装满酸性(H2SO4)KBr溶液的电解槽阳极上的氧化反应,电解槽的阳极室与阴极室是隔开的。当测量某地区空气中SO2含量时,空气(经过除尘)以1.5×10-4 m3·min-1的流速进入电解槽的阳极室,电流计显示每分钟通过电子是5.136×10-9 mol,此条件下能保持溴浓度恒定并恰好与SO2完全反应。设被测空气中不含其他能与溴反应的杂质。
(1)写出此监测过程中发生的主要反应的化学方程式。
(2)计算该地区空气中SO2的含量(g·m-3)(保留两位小数)。
用Pt电极电解浓度为17%的饱和硝酸银溶液,当金属银完全析出时,阳极上放出5.6 L气体(标准状况),电解后溶液的密度为1.038 g·cm-3。试计算:
(1)电解前原硝酸银溶液的总质量是多少?电解析出的银多少克?
(2)电解前硝酸银的溶解度是多少?
(3)电解后所得溶液的质量分数和物质的量浓度各为多少?
有电解装置如图4-37。图中B装置盛1 L 2 mol·L-1 Na2SO4溶液,A装置中盛1 L 2 mol·L-1 AgNO3溶液。通电后,润湿KI淀粉试纸的C端变蓝色,电解一段时间后,试回答: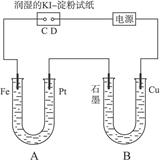
图4-37
(1)A中发生反应的化学方程式为______________________________。
(2)在B中观察到的现象是_________________________。
(3)室温下,若从电解开始到时间为t时,A、B装置中共收集到气体0.168 L(标准状况),若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A溶液的pH为_______。
由实验得知用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电荷量Q正比于金属的物质的量n和金属离子化合价a的乘积,Q=F·na,其中F是一恒量,称为法拉第常数,它与金属的种类无关(阿伏加德罗常数NA=6.023×1023 mol-1,电子电荷量e=1.6×10-19 C,Cu的摩尔质量:64×10-3 kg·mol-1)。
(1)试求出法拉第常数F(电荷量以库仑为单位,保留三位有效数字)。
(2)如果电解硫酸铜溶液获得1 kg的金属铜,通过电解槽的电荷量是多少?
(3)用电镀的方法在半径为R的铜球表面均匀地镀上很薄的银层,在电镀槽中铜球是阳极还是阴极?另一电极是什么材料?若电流为I,通电时间为t,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度d。