下表中的数据是破坏1 mol物质的化学键所消耗的能量:
| 物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
431 |
366 |
298 |
436 |
根据上述数据回答:
(1) 下列氢化物中,最不稳定的是
A.HCl B.HBr C.HI
(2)H2和Cl2反应生成HCl过程中的热效应可用下图表示,请回答下列问题:
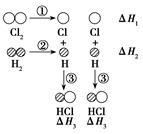
①ΔH1= kJ·mol-1,ΔH2= kJ·mol-1,ΔH3= kJ·mol-1。
②据实验测定,H2和Cl2的混合气体在光照下反应生成HCl,引发该反应的步骤是上图①~③中分子转化为原子的一步,你认为是第 (填序号)步,请说明原因: 。
③该反应的热化学方程式为 。
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知: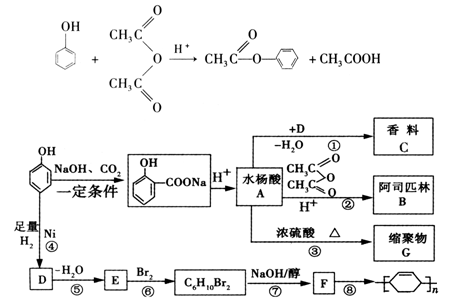
(1)写出C的结构简式。
(2)写出反应②的化学方程式。
(3)写出G的结构简式。
(4)写出反应⑧的化学方程式。
(5)写出反应类型:④,⑦。
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质: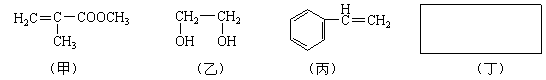
填写下列空白:
(1)甲中不含氧原子的官能团是。
(2)甲的同分异构体有多种,写出其中一种不含甲基的链状羧酸的结构简式。
(3)淀粉通过下列转化可以得到乙(其中A~D均为有机物):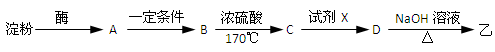
A的分子式是,试剂X可以是。
(4)利用以下信息,以苯、乙烯、氯化氢为原料经三步反应合成丙:(—R为烃基)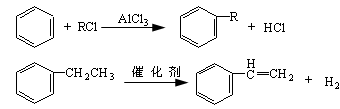
其中属于取代反应的化学方程式是。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁的核磁共振氢谱图像仅有2个波峰,强度比为2:1。则丁的结构简式为。
根据图示回答下列问题: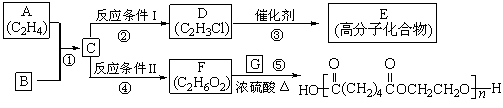
(1)写出A、E、G的结构简式:A____________,E___________,G___________;
(2)反应②的化学方程式(包括反应条件)是:_______________________
反应④化学方程式(包括反应条件)是:__________________________________;
(3)写出①、⑤的反应类型:①________________、⑤______________。
I.请根据官能团的不同对下列有机物进行分类。(将序号填入空格处)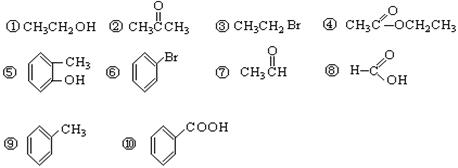
(1)芳香烃:;(2)羧酸:;(3)酯;
(4)醇:;(5)酚:。
II.写出下列有机物的结构简式
(1)间甲基苯乙烯:_____________________;(2) 2-甲基丙醛:______________________;
(3)组成为C4H8的烯烃中的顺反异构_____________________和______________________。
(16分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s)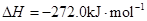
2Al(s)+3/2O2(g)= Al2O3(s)
Al和FeO发生铝热反应的热化学方程式是_____________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率___ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性____________
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为。(填序号)
a..NH4HCO3 b.NH4Ac.(NH4)2CO3 d.NH4Cl