在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体
b.适当升高温度
c.增大CO2的浓度
d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是 (多选不得分)。
A.容器中压强不变
B.混合气体中 c(CO)不变
C. 正(H2)=
正(H2)= 逆(H2O)
逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 ,CO2的物质的量为 。
A.等于1.0mol
B.大于1.0mol
C.大于0.5mol,小于1.0mol
D.无法确定
LiFePO4电池具有稳定性高、安全、对环境友好等优点。某电极的工作原理如左下图所示,该电池电解质为能传导 Li+的固体材料。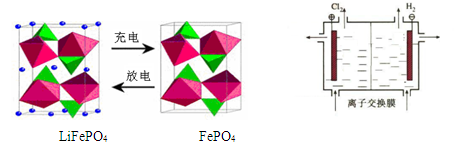
(1) 放电时,该电极为_____极,电极反应为__________________________
(2) 充电时该电极连接外接电源的______极
(3) 放电时,电池负极的质量_______(减少、增加、不变)
(4) LiOH可做制备锂离子电池电极的材料,利用如右上图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。阴极区电解液为__________溶液(填化学式),离子交换膜应使用__________(阳、阴)离子交换膜。
如图是一个甲烷燃料电池工作时的示意图。M、N两电极的质量相同,其中一个为银电极一个为铁电极。
(1)写出通入甲烷的铂电极上的电极反应式为__________________________。
(2)若一段时间后M与N两电极的总质量不变,则N电极是 。此时两电极质量差为5.4g,甲池中理论上消耗氧气 mL(标准状况)
(3)若一段时间后M与N两电极的总质量增加4g,N电极质量变化为________克。
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
(1)装置A中发生反应的离子方程式为_____________________________。
(2)该实验装置明显存在不足之处,改进的措施为____________________
(3)已知在装置C中通入一定量的氯气后,观察到测得D中有黄红色的气体(提示:是一种氯的氧化物)。已知C中所得固体含有NaHCO3。现对C中的成分进行猜想和探究。
①提出合理假设.
假设一:存在两种成分,为NaHCO3、NaCl
假设二:存在三种成分,为NaHCO3、Na2CO3、NaCl
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假设二成立.
若C中有0.1molCl2恰好与10.6gNa2CO3反应,且假设一成立,由此可推知C中反应生成的氯的氧化物为
(写化学式),写出C中发生反应的化学方程式 。
(1)用18mol/L浓硫酸配制100mL 1.0mol/L的稀硫酸,若实验仪器有:
A.100mL量筒 B.玻璃棒 C.托盘天平 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
实验时必须选用的仪器是(填入字母)
(2)在配制过程中,下列操作不正确的是
A.使用容量瓶前需检查它是否漏水
B.将蒸馏水注入容量瓶中,液面离刻度线下1-2cm时,改用胶头滴管滴加至液面与刻度线相切
C.配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线
D.定容后盖好瓶塞,反复上下颠倒,摇匀
(3)若实验时遇到下列情况,将使所配溶液的浓度偏高的是
A.在配制前用稀硫酸润洗容量瓶后,未用蒸馏水洗涤
B.定容摇匀后,发现液面低于刻度线,再加入蒸馏水至与刻度线相切
C.洗涤量筒,并将洗涤液转入容量瓶
D.定容时仰视读数
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若A是当前最常用的太阳能转换为电能的材料。
(2)C的水溶液俗称水玻璃,D为硅酸。则:写出反应②的化学方程式 。写出反应③的离子方程式 。
(2)若A是应用最广泛的金属。反应①、⑤均用盐酸,D物质是红褐色。则:
写出反应③的化学方程式 。B溶液中加入NaOH溶液的现象是 ,沉淀颜色发生变化对应的化学方程式是 。
C的溶液用于蚀刻印刷铜电路板(铜质),写该反应的离子方程式 。
(3)若D物质是常见的两性氢氧化物,反应②③⑤均要用强碱溶液,反应④是通入过量的CO2。则:反应②的离子方程式为 。反应④的离子方程式为 。