足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L—1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.50 mL | C.30 mL | D.15 mL |
下列电子式书写错误的是 ( )
以下物质;(1) 甲烷;(2) 苯;(3) 聚乙烯;(4) 苯乙烯;(5) 2-丁炔;(6) 环己烷;(7) 邻二甲苯。既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是
| A.(3) (4) (5) | B.(4) (5) (7) | C.(4) (5) | D.(3) (4) (5) (7) |
下列有关苯酚的实验事实中,能说明侧链对苯环性质有影响的是
| A.苯酚与浓溴水反应生成三溴苯酚 | B.苯酚能和NaOH溶液反应 |
| C.苯酚燃烧产生带浓烟的火焰 | D.1mol苯酚与3mol H2发生加成反应 |
新兴的大脑营养学研究发现,大脑的生长发育与不饱和脂肪酸有密切的关系,从深海鱼油中提取的,被称为“脑黄金”的DHA就是一种不饱和程度很高的脂肪酸,它的分子中含6个碳碳双键,化学名称为二十二碳六烯酸,则它的分子组成应为
| A.C22H39COOH | B.C21H42COOH | C.C22H33COOH | D.C21H31COOH |
有机物的种类繁多,但其命名是有规则的。下列有机物用系统命名法命名正确的是
A.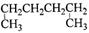 1,4—二甲基丁烷 1,4—二甲基丁烷 |
B. 3—甲基丁烯 3—甲基丁烯 |
C. 2—甲基丁烷 2—甲基丁烷 |
D. 邻二甲苯 邻二甲苯 |