根据题目要求,回答有关问题。
(1)选用下列仪器的编号填空。
①容量瓶 ②分液漏斗 ③蒸馏烧瓶 ④烧杯 ⑤量筒 ⑥托盘天平 ⑦蒸发皿 ⑧试管
可用来加热,且加热时必须垫石棉网的仪器有 ____________ ;
使用时必须检查是否漏水的仪器有_______________;
标有零刻度的仪器有_____________;在仪器上标有使用温度的仪器有___________。
(2) 物质的提纯与分离的方法有:过滤、蒸发结晶、冷却热的饱和溶液的方法结晶(重结晶)、萃取、蒸馏、洗气、升华、高温灼烧等方法。
①从海水中获得淡水应选用 ___________方法,请写出操作的其中两个注意点:
__________________________; _________________________。
②从含有少量氯化钾的硝酸钾溶液中提硝酸钾,应先在_______________下溶解混合物形成浓溶液,再__________________,最后____________可得到硝酸钾晶体。
③除去CO气体中的CO2,可选用__________方法,将混合气体通入____________(填浓NaOH溶液或澄清石灰水)
X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有右图转化关系(部分反应物、产物及反应条件已略去)。请回答: 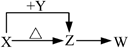
(1)W的分子式是
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。(该气体可以使带火星的木条复燃)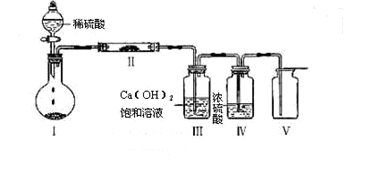
①装置Ⅰ中反应的化学方程式是,
装置Ⅱ中物质的化学式是。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是,所需仪器装置是
(从上图中选择必要装置,填写编号)。
向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X和另一种物质生成,该反应的化学方程式是
下图所示物质中(部分产物和反应条件未标出),只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体。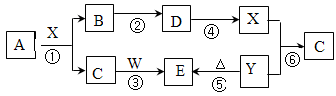
据此回答下列问题:
(1)物质W的名称为,由B生成D的化学方程式为。
(2)请写出X和 Y反应的离子方程式:。
(3)上图反应中不属于氧化还原反应的有(填写序号)。
(4)写出A和X反应的化学方程式;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为。
(5)请写出C和W反应的化学方程式:。在这个反应中生成1mol气体转移电子的物质的量为。
1 (6分)有以下几种物质
①乙醇②MgCl2晶体③蔗糖④铜⑤食盐水⑥BaSO4
请填空回答(填序号)。
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中属于非电解质的是。
2.(4分)现有CO和CO2的混合气体18g,充分与氧气反应后测得所得到的CO2的总体积为11.2L(标准状况)。试计算
(1)原混合气体中CO2的体积(标准状况)是,
(2)原混合气体在标准状况下的密度是g/L (结果保留一位小数)
(10分)某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。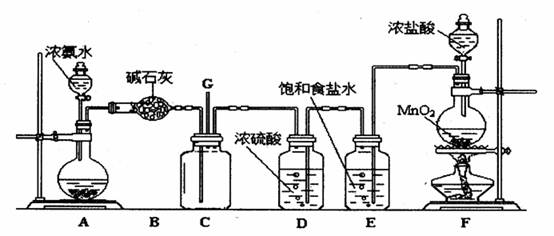
请回答下列问题:
(1)装置F中发生反应的化学方程式为.
(2)装置B中仪器的名称是;装置E的作用是.
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
写出反应的化学方程式.
(4)装置C内当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数
常数为mol-1 (用含a、b的代数式表示)。
(5)将用F、E、D装置制得的氯气通人含74gCa(OH)2的石灰乳中,最多可制得漂白粉g.
(8分)已知:CH3CH2OH+NaBr+H2SO4(浓)  CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
①按右图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应。
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为
。
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色。将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取(填“上层”或“下层”)液体。为了除去其中的杂质,可选择下列试剂中的(填序号)。
| A.Na2SO3溶液 | B.H2O | C.NaOH溶液 | D.CCl4 |
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行(填操作名称)。
(4)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后(填序号)。
①加热②加入AgNO3溶液③加入稀HNO3酸化④加入NaOH溶液⑤冷却