尼龙66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出了两条合成路线).
已知:R—Cl R—CN
R—CN R—CH2NH2
R—CH2NH2
完成下列填空:
(1)写出反应类型:反应②________________________;反应③______________________.
(2)写出化合物D的结构简式:____________________________________________.
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:
________________________________________________________________________
________________________________________________________________________.
(4)写出反应①的化学方程式:
________________________________________________________________________.
(5)下列化合物中能与E发生化学反应的是______.
a.NaOH b.Na2CO3
c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):________________
________________________________________________________________________.
煤燃烧的反应热可通过以下两种途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1①
b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
H2(g)+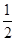 O2(g)===H2O(g)ΔH=E3③
O2(g)===H2O(g)ΔH=E3③
CO(g)+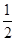 O2(g)===CO2(g)ΔH=E4④
O2(g)===CO2(g)ΔH=E4④
请回答:
(1)与途径a相比,途径b有较多的优点,即______________________________________。
(2)上述四个热化学方程式中的哪个反应ΔH>0?____________。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是_______。
A.a比b多B.a比b少C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为______________________________。
(5)已知:
①CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/mol
②H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3="-1370" kJ/mol
则④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=______________。
(共6分)(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,混合后得到密度为1.17 g·cm-3的溶液。请计算:
①混合后的溶液中NaCl的质量分数是
②混合后的溶液的物质的量浓度为mol/ L
(2)在标准状况下,1L水溶解了一定体积的NH3,所得溶液的密度为ρg·cm-3,物质的量浓度为amol·L-,则所溶解的NH3的体积为L
(8分)现有 A、B、C、D、E五瓶无色溶液分别是HC1、BaCl2、NaHSO4、K2CO3、AgNO3溶液中的一种,已知:
①A与B反应有气体产生
②B与C反应有沉淀生成
③C与D反应有沉淀生成
④D与E反应有沉淀生成
⑤A与E反应有气体产生
⑥在②、③反应中生成的沉淀为同一种物质.
请填写下列空白: (1)A是,B是,D是。
(2)写出⑤反应的离子方程式.
(3)将 0.1 mol/L 的 Ba(OH)2溶液与 0.1 mol/L 的E溶液按下表中的不同配比进行混合:
| 甲 |
乙 |
丙 |
丁 |
戊 |
|
| 0.1 mol/L 的Ba(OH)2溶液的体积/mL |
10 |
10 |
10 |
10 |
10 |
| 0.1 mol/L 的E溶液的体积/mL |
5 |
10 |
15 |
20 |
25 |
①按丁方式混合后,所得溶液显 (填"酸""碱""中" )性.
②按乙方式混合时,反应的离子方程式为.
(12分)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应氧化产物与还原产物质量比是
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是___________________________;
(3)某学生在一次分液操作中发现上下层溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断____________________________ 。
(4)在容量瓶的使用方法中,下列操作正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(5)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的硫酸溶液450mL,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______ mL,如果实验室有15mL、20mL、50mL量筒,应选用________ mL量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是_____________
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
 (1)已知KBrO3在反应中得到电子,则该反应的还原剂是。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是。 (2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为。 (3)根据上述反应可推知。
(3)根据上述反应可推知。 a.氧化性:KBrO3>H3AsO4b.氧化性:H3AsO4> KBrO3
a.氧化性:KBrO3>H3AsO4b.氧化性:H3AsO4> KBrO3 c.还原性:AsH3>X d.还原性:X > AsH3
c.还原性:AsH3>X d.还原性:X > AsH3 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方 向和数目:
向和数目:
