四个体积相同的密闭容器中,在一定条件下,发生如下反应:N2+3H2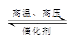 2NH3,化学反应速率最小的是
2NH3,化学反应速率最小的是
| 容器 |
温度(℃) |
N2(mol) |
H2(mol) |
催化剂 |
| A |
500 |
1 |
3 |
有 |
| B |
500 |
0.5 |
1.5 |
有 |
| C |
450 |
1 |
3 |
无 |
| D |
450 |
0.5 |
1.5 |
无 |
下列关于物质分类的说法正确的是
| A.油脂、糖类、蛋白质均是天然高分子化合物 |
| B.三氯甲烷、氯乙烯、三溴苯酚均是卤代烃 |
| C.CaCl2、烧碱、聚苯乙烯均为化合物 |
| D.稀豆浆、硅酸、雾霾均为胶体 |
乳制品富含钙,紫菜富含铁.这里的“钙”和“铁”指的是
| A.分子 | B.元素 | C.单质 | D.氧化物 |
APEC会址选择在雁栖湖作为主会场是为了彰显绿色环保的理念,为此要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源。下列有关做法与此不相符的是
| A.在西部和沿海地区兴建风力发电站,解决能源问题 |
| B.回收废弃的饮料包装纸,制作成公园内的休闲长椅 |
| C.大力开发丰富的煤炭资源,减少对石油的依赖 |
| D.鼓励购买小排量汽车,推广电动、混合动力汽车 |
下列叙述正确的是
| A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成 |
| B.向Na2 CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 |
| C.等质量的Na HCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D.向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
下列叙述中正确的是
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |