下列离子方程式或化学方程式与所述事实相符且正确的是
| A.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH﹣=H2O |
| B.稀硝酸中加入过量铁粉:Fe+4H++NO3﹣═Fe3++NO↑+2H2O |
| C.表示硫酸与氢氧化钡反应的中和热的热化学反应方程式为: 1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)△H=﹣57.3 kJ/mol |
| D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42﹣完全沉淀: |
Al3++2SO42﹣+2Ba2++4OH﹣=AlO2﹣+2BaSO4↓+2H2O
一定温度下,1 mol X和n mol Y在容积为2 L的密闭容器中发生如下反应:
X(g)+Y(g) 2Z(g)+M(s)
2Z(g)+M(s)
5min后达到平衡,此时生成2amol Z。说法正确是
| A.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
| B.用M表示此反应速率是0.1 amol·(L·min)-1 |
| C.用X表示此反应的反应速率是(0.1-0.2 a)mol·(L·min)-1 |
| D.当混合气体的压强不再发生变化时,说明反应达到平衡状态 |
将4molA气体和2molB气体在2L的恒容容器中,并在一定条件下发生如下反应:2A(g)+B(g)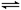 2C(g),若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法
2C(g),若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法
①用物质A表示的反应速率为0.3 mol·L-1·s-1
②用物质B表示的反应速率为0.6 mol·L-1·s-1
③2s时物质A与物质B的转化率相等
④2s时物质B的浓度为0.7mol·L-1,其中正确的是
| A.①③④ | B.①②④ | C.②③④ | D.①②③④ |
分析下图所示的四个原电池装置,其中结论正确的是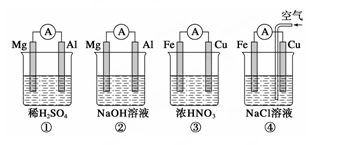
| A.①②中Mg作负极,③④中Fe作负极 |
| B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑ |
| C.③中Fe作正极,电极反应式为Fe-2e-===Fe2+ |
| D.④中Cu作正极,电极反应式为2H++2e-===H2↑ |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是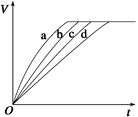
| 组别 |
对应曲线 |
c(HCl)/mol·L-1 |
反应温度/℃ |
铁的状态 |
| 1 |
a |
30 |
粉末状 |
|
| 2 |
b |
30 |
粉末状 |
|
| 3 |
c |
2.5 |
块状 |
|
| 4 |
d |
2.5[ |
30 |
块状 |
A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度大于2.5 mol·L-1
C.第2组实验中盐酸的浓度等于2.5 mol·L-1
D.第3组实验的反应温度低于30 ℃
一定量的锌片与过量2 mol·L-1的盐酸跟反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.通入一定量的HCl气体 | B.加入数滴氯化铜溶液 |
| C.加入一定量6mol·L-1的硝酸溶液 | D.加入适量的CH3COONa固体 |