影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。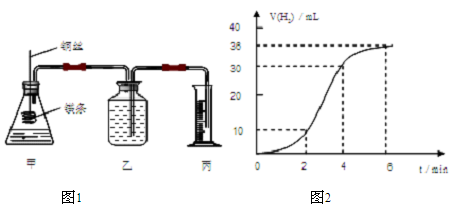
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①计算0~4min内H2的化学反应速率为______________ mL/min。
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:_______。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:__________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:___________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中______________________,实验b中______________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(⑸题3分,其余每空2分,共15分)四种短周期元素A、D、E、G,原子序数依次增大,A、G同主族,D、E同周期;A和D、E、G的单质都可以在一定条件下化合依次生成共价化合物甲、乙和离子化合物丙,丙和乙剧烈反应得到强碱溶液X和A的单质。请回答:
⑴化合物丙和乙的反应的化学方程式是________________;
⑵A和E两种元素构成的一种化合物,其水溶液显弱酸性,试用恰当的方程式解释该溶液呈弱酸性的原因_____________________________________________________;
⑶将A、D、E三种元素构成的一种化合物与X恰好反应,所得溶液呈碱性;试用恰当的方程式解释该溶液呈碱性的原因__________________________________________,该溶液中存在的离子有(请用离子符号按浓度由大到小的顺序以“>”连接填写)__________________________________________;
⑷在丙和乙的反应中,当转移1.5mol电子时,得到A单质__________ g;若同时得到X的溶液0.50L,则所得溶液的物质的量浓度为__________________________。
⑸工业制取甲的反应为:D2(g)+3A2(g) 2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
A.将甲不断从反应体系中分离 B.减小反应体系的压强 C.降低反应体系的温度
D.加入适当的催化剂 E.向体系中充入D2和A2
如下图所示:已知A、D、E、F是中学化学中常见单质,B、C是氧化物,且B的相对分子质量是232。
请填空:
(1) A是________,E是________(填化学式)
(2) C电解的化学方程式为________________________。
(3) 写出工业以B为原料冶炼D的化学方程式___________________、_________________。
(4) 熔融状态下,金属钠和G能组成可充电电池(装置示意图如下),反应原理为:Na + G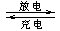 NaCl +D
NaCl +D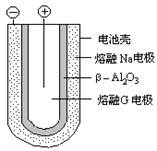
放电时,正极反应为___________________,阳离子迁移途径为________________________。
4分)写出下列物质或原子团的电子式
(1)NaOH ;(2)C2H4;(3)CH3Cl;(4)-OH。
在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A(g)+B(g)  2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
(1)2min内B的反应速率为_________________
(2)此温度下该反应的平衡常数K=_________________________
(3)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2 (s) + 4HF(g)  SiF4 (g) + 2H2O(g)△H=-148.9 kJ/mol,根据题意完成下列填空:
SiF4 (g) + 2H2O(g)△H=-148.9 kJ/mol,根据题意完成下列填空:
(1)在地壳深处容易有__________气体逸出,在地壳浅处容易有________沉积
(2)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,____________(选填编号)。
a.2v正(HF)=v逆(H2O) b.混合气体的密度保持不变
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(3)如果上述反应的平衡常数K值变大,该反应_________(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为__________________________。