聚苯乙烯可用于制备高频绝缘材料,苯乙烯在一定条件下存在如下图转化关系。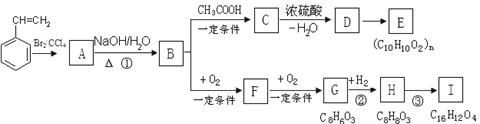
请回答下列问题:
(1)由苯乙烯合成这种高聚物的化学方程式为 。
(2)反应①的反应类型是 ,C→D的反应类型是 。
(3)C可能的结构简式有 。
(4)H有多种同分异构体。同时符合下列条件的同分异构体共有 种。
a.与FeCl3溶液发生显色反应
b.1 mol H最多能与3 mol NaOH反应;
c.苯环上只有两个取代基。
(5)反应③的化学方程式是 。
现有CO2和N2两种气体
(1)当二者的质量相等时,在相同状况下,体积比为 ,密度之比为 ,分子数之比为 。
(2)在相同状况下,当二者的体积相同时,质量比为 ,密度之比为 ,分子数之比为 。
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂;是还原剂;元素被氧化;元素被还原;是氧化产物;是还原产物;1mol K2Cr2O7反应时转移电子为mol.
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
t℃时,将3 mol A 和1 mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g) + B(g)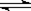 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为_______________________。
(2)达到平衡状态时,B 物质的转化率α(B) = _____________,
平衡常数K= _____________________(填计算结果)。
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡__________(填字母)
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)==Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是,其还原产物是;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H0(填“>”、“<”或“=”);升高温度,其平衡常数值(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率 与时间t的关系如右图。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
与时间t的关系如右图。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是(提示:272 = 729)