下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )
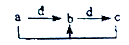
| 物质 选项 |
a |
b |
c |
d |
| A |
Al |
Al(OH)3 |
NaAlO2 |
NaOH |
| B |
C |
CO |
CO2 |
O2 |
| C |
NaOH |
Na2CO3 |
NaHCO3 |
CO2 |
| D |
AlCl3 |
Al(OH)3 |
NaAlO2 |
NaOH |
将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是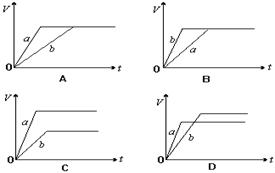
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 = 2Fe2++4OH-。以下说法正确的是
| A.负极发生的反应为:Fe-2e-= Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-= 4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
在一容积可变的密闭容器中,aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.化学计量数关系a>b |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,
如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是
| A.铝罐将逐渐被腐蚀 |
| B.碳棒上发生的反应为:O2+4e-===2O2- |
| C.碳棒应与玩具电机的负极相连 |
| D.该电池工作一段时间后碳棒的质量会减轻 |
下列关于实验现象的描述不正确的是
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.用锌片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面析出铜 |
| C.把铜片插入三氯化铁溶液,在铜片表面析出铁 |
| D.把锌放入稀盐酸中,加几滴氯化铜溶液,产生气泡速率加快 |