下列离子方程式书写正确的是()
| A.等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O |
| B.FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| C.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O |
| D.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g)  xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是
| A.x的值为2 | B.A的转化率为40% |
| C.B的平衡浓度为0.8 mol/L | D.D的体积分数为20% |
若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
| A.Al3+、Na+、NO3-、Cl- | B.K+、Na+、Cl-、NO3- |
| C.K+、Na+、Cl-、AlO2- | D.K+、NH4+、SO42-、NO3- |
铜锌原电池在工作时,下列叙述正确的是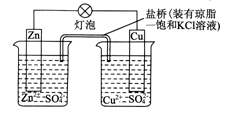
| A.正极反应为:Zn-2e-=Zn2+ |
| B.电池反应为:Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电流从负极流向正极 |
| D.盐桥中的K+移向ZnSO4溶液 |
25℃时,2L pH=13的Ba(OH)2溶液与浓度和它相同的3L NaHSO4溶液混合,反应完全时,生成沉淀的物质的量和此时溶液的pH分别为
| A.0.1mol pH=12 | B.0.02mol pH=2.7 |
| C.0.15mol pH=1 | D.0.3mol pH=10.7 |
相同条件下,pH相同的盐酸和醋酸两种溶液中,它们
| A.H+ 的物质的量相同 | B.物质的量浓度相同 |
| C.H+ 的物质的量浓度不同 | D.H+ 的物质的量浓度相同 |