现有易溶于水的五种物质A、B、C、D、E,其中一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
| 阳离子 |
Na+、H+、Ba2+ |
| 阴离子 |
OH-、CO32-、SO42- |
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X_______,C________,B_________。
(2)完成A溶液与X气体反应的离子方程式:__________。
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为________。
(4)已知NaHCO3溶液呈碱性。B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子反应方程式___。
已知有机化合物 A、B、C、D、E存在下图所示转化关系,且C能跟NaHCO3发生反应,C和D的相对分子质量相等,E为无支链的化合物。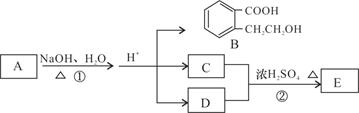
请回答下列问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为。
(2)B在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为。
(3)C的核磁共振氢谱中有个峰;D也可以由卤代烃F在NaOH溶液中加热来制取,写出此反应的化学方程式。
(4)A的结构简式是。
(5)B有多种同分异构体,请写出一种同时符合下列四个条件的结构简式:。
a.能够发生水解 b.能发生银镜反应
c.能够与FeCl3溶液显紫色 d.苯环上的一氯代物只有一种
有机物A的结构简式为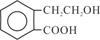 ,可通过它用不同化学反应分别制得B、C和D 三种物质。
,可通过它用不同化学反应分别制得B、C和D 三种物质。
B 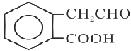 C
C 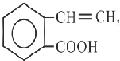 D
D 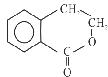
(1)B中的含氧官能团名称是;A→C的反应类型是。
(2)由A生成B的化学方程式是。
(3)C在一定条件下发生加聚反应的化学方程式是。
(4)C的同分异构体中,有多种反式结构,写出其一种的结构简式。
(5)D在酸性条件下水解的化学方程式是。
聚苯乙烯的结构为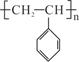 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的链节是_________________,单体是___________________;
(2)实验测得聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为________________。
观察下列结构简式,回答下列问题:
(1)有机物名称是__________________________。
(2)此有机物为单烯烃加成的产物,则原来烯烃的结构可能有_______种。
如下图,回答问题:
(1)A装置是将能转化为能。
(2)Zn是极, 电极反应式为 ; Cu电极反应式为 ;
Pt是极, 电极式为 ;石墨电极反应式为 。
(3)电解一段时间后发现石墨电极增重6.4g,则外电路中通过的电子的物质的量是 摩尔, 