下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
过量的Fe粉中加入HNO3 充分反应后,滴入KSCN溶液 |
溶液呈红色 |
稀HNO3将Fe氧化为Fe3+ |
| B |
NO2球浸泡在冰水中 |
颜色变浅 |
生成N2O4的反应是吸热过程 |
| C |
Na2S2O3溶液与稀硫酸反应,改变反应的温度 |
只有浑浊产生,温度越高,出现浑浊时间越短 |
温度越高,反应速率越快 |
| D |
向重铬酸钾稀溶液中滴加3-10滴浓硫酸 |
溶液橙色加深 |
加酸抑制Cr2O72-向CrO42-的转化 |
下列物质之间的转化符合:“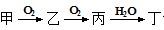 ”的组合是
”的组合是
①Na→NaOH;②Cu→Cu(OH)2;③S→H2SO4;④NH3→HNO3
| A.①②③ | B.①③④ | C.②③④ | D.全部 |
下列关于氯气的叙述中不正确的是
| A.可用向上排空气法收集少量的氯气 |
| B.与水反应生成的次氯酸是一种弱酸 |
| C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.与氢氧化钠溶液反应时,Cl2既被还原,同时又被氧化 |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.室温下,1L pH=1的盐酸中,由水电离的H+离子数目为0.1NA |
| B.标况下,11.2L SO3所含的分子数目为0.5 NA |
| C.甲烷碱性燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA |
| D.1 mol C2H6O分子中含有的O—H键数目一定为NA |
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重124 g,则某气体的相对分子质量为
| A.48 | B.28 | C.32 | D.4 |
纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是
| A.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.分别放在炒锅中加热,观察是否有残留物 |