对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H= +49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H= -192.9 kJ·mol-1
下列说法正确的是
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
B.反应①中的能量变化如图所示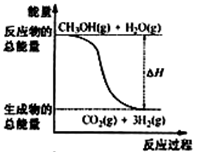 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1 |
25℃和1.01×105Pa,反应2N2O5(g) = 4NO2(g) + O2(g);△H=" +" 56.76 kJ·mol-1能自发进行反应的原因是
| A.是吸热反应 |
| B.是放热反应 |
| C.是熵减少的反应 |
| D.熵增大效应大于能量效应 |
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
| A.50 | B.0.02 | C.100 | D.无法确定 |
对平衡CO2(g) CO2(aq) .△H=-19.75KJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq) .△H=-19.75KJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
| A.升温增压 | B.降温减压 |
| C.升温减压 | D.降温增压 |
根据热化学方程式:S(s) + O2(g)= SO2(g);△H=akJ·mol-1(a=-297.2),分析下列说法中不正确的是
| A.S(s)在O2(g)中燃烧的反应是放热反应 |
| B.S(g) + O2(g)= SO2(g);△H=bkJ·mol-1,则a<b |
| C.1mol SO2(g)所具有的能量低于1mol S(s)与1mol O2(g)所具有的能量之和 |
| D.16克固体硫在空气中充分燃烧,可放出148.6kJ的热量 |