今有室温下四种溶液,下列叙述不正确的是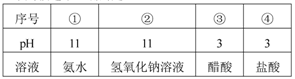
| A.③④中分别加入适最的醋酸钠晶体后,两溶液的pH均增大 |
| B.②③两溶液等体积混合.所得溶液中c(H+)>c(OH-) |
| C.分别加水稀释10倍.四种溶液的pH值大小关系为:①>②>④>③ |
| D.V1L④与V2L①溶液混合后,若混合后溶液pH=7.则V1<V2 |
强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①浓硫酸 ②稀硝酸,恰好完全反应的热效应依次为ΔH1、ΔH2,则二者的关系正确的是
| A.ΔH1=ΔH2 | B.ΔH1>ΔH2 |
| C.ΔH2>ΔH1 | D.无法比较 |
在25℃、1.01×105Pa时,1gCH4燃烧时生成CO2与液态H2O,放出55.6kJ的热量,则CH4的燃烧热为
| A.55.6kJ/mol | B.889.6kJ/mol | C.-889.6kJ/mol | D.444.8kJ/mol |
表示正反应是吸热反应的图像是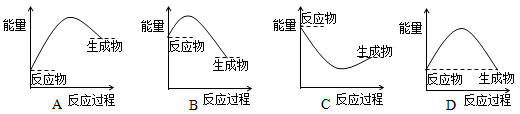
在298 K、100 kPa时,已知:①2H2O(g)===O2(g)+2H2(g)ΔH1
②Cl2(g)+H2(g)===2HCl(g)ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是
| A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+28.7kJ/mol |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-28.7kJ/mol |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.4kJ/mol |
| D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ/mol |