工业常用燃料与水蒸气反应制各H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4kJ·mol-1,下列判断正确的是_______。
CO(g)+H2(g) △H=+131.4kJ·mol-1,下列判断正确的是_______。
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)  C(s)+H2O(l) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(l) △H=-QkJ·mol-1,则Q<131.4
D.若C(s)+CO2(g)  2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g)  H2(g)+CO2(g) △H2则:△H1+△H2="+131.4" kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2="+131.4" kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| |
不同时间各物质的物质的量/mol |
|||
| 0min |
2min |
4min |
6min |
|
| CH4 |
2.00 |
1.76 |
1.60 |
n2 |
| H2 |
0.00 |
0.72 |
n1 |
1.20 |
根据表中数据计算:
①0min~2min内H2的平均反应速率为_______。
②达平衡时,CH4的转化率为________。在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比______(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______(填字母)
A.CO的含量保持不变
B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变
D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。
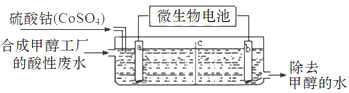
①a电极的名称为________。
②写出除去甲醇的离子方程式____________