在25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是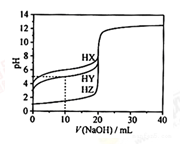
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-6 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时: c(X-)>c(Y-)>c(OH-)>c(Na+)>c(H+) |
| D.HY与HZ混合,达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-) |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图。下列说法正确的是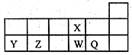
| A.Y、Z的常见氧化物可通过加入过量的NaOH溶液来分离 |
| B.其氢化物的稳定性由弱到强的顺序是Q、W、Z |
| C.元素Y、Z、W、Q的原子半径依次增大 |
| D.Y单质做的容器可盛装W的最高价氧化物对应的水化物的浓溶液 |
下列说法正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.若“M + N =" X" + Y”为放热反应,则1mol X和1mol Y的总能量一定大于1mol M和1mol N的总能量 |
| C.“H2(g)+ Cl2(g)= 2HCl(g) △H=" -" 183kJ/mol”表示1分子H2和1分子Cl2反应,放出热量183kJ |
| D.化学反应必然引起化学键的变化,化学反应也必然伴随能量的变化 |
用NA表示阿伏伽德罗常数的值,下列说法正确的是
| A.24g NaH中阴离子所含电子总数为NA |
| B.1mol苯分子中含有3NA个碳碳单键 |
| C.NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA |
| D.在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
下列离子方程式书写正确是
A.氯化亚铁溶液中加入硝酸: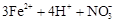 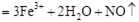 |
B.氯化铁溶液中通入硫化氢气体: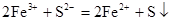 |
C.次氯酸钙溶液中通入过量二氧化碳: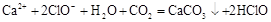 |
| D.碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3—+OH-=CaCO3↓+H2O: |
下列实验中,能够达到实验目的的是