下列离子方程式书写错误的是
| A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O |
| B.酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2O |
C.HCO3-的电离方程式:HCO3-+H2O H2CO3+OH- H2CO3+OH- |
| D.Cl2与H2O反应:Cl2+H2O=H++Cl-+HClO |
下列说法错误的是
| A.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒 |
| B.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| C.若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶 |
| D.对“地沟油’’蒸馏可以获得汽油 |
在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)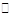 N2(g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
| 温度 |
时间/min 物质的量 |
0 |
10 |
20 |
40 |
50 |
| T1 |
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
| T2 |
n(CH4)/mol |
0.50 |
0.30 |
0.18 |
x |
0.15 |
下列说法正确的是
A.T1>T2,且a>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆)
25℃时,向20 mL 0.2 mol/L H2A(某二元弱酸)溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法中正确的是
A.当V(NaOH)=20mL时,所得溶液中:c(OH-)> c(H+)
B.当V(NaOH)=30mL时,所得溶液中:2c(H+) + c(HA-)+ 3c(H2A) = c(A2-) + 2 c(OH-)
C.当V(NaOH)=40mL时,所得溶液中:c(Na+)> c(A2-) >c(H+)> c(HA-) >c(OH-)
D.在NaHA溶液中:c(OH-)+2c(A2-) = c(H+)+2c(H2A)
已知:① C(s)+O2(g)=CO2(g)△H1;② CO2(g)+C(s)=2CO(g)△H2;
③ 2CO(g)+O2(g)=2CO2(g)△H3;④ 4Fe(s)+3O2(g)=2Fe2O3(s)△H4;
⑤3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列判断正确的是
| A.上述反应中△H1~ H5均大于0 | B.△H1=△H2- △H3 |
| C.3△H3=△H4 + 2 △H5 | D.△H5=3△H1+△H4 |
Cl2O与OF2互为等电子体,均能与水反应(与水解反应原理类似),Cl2O与水反应的化学方程式为:Cl2O+H2O=2HClO。下列说法正确的是
| A.Cl2O与水的反应属于氧化还原反应 |
| B.OF2、Cl2O分子的立体构型均为直线形 |
| C.Cl2O分子中的共用电子对偏向Cl ,OF2分子中的共用电子对偏向F |
| D.OF2与水反应的化学方程式为:OF2 + H2O =" 2HF" + O2 |