已知:2NaAlO 2 + 3H2O +CO2→2Al(OH)3↓+Na2CO3。向含2molNaOH、 1 mol Ba(OH)2、2 molNaAlO 2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是
| 选项 |
A |
B |
C |
D |
| n(CO2)mol |
2 |
3 |
4 |
6 |
| n(沉淀) mol |
2 |
2 |
3 |
3 |
下列说法正确的是
| A.石油的分馏和煤的气化都是发生了化学变化 |
| B.纤维素、油脂和蛋白质在一定条件下都能水解 |
| C.二氧化硅是半导体材料,可将太阳能直接转化为电能 |
| D.乙烯和苯都能使酸性KMnO4溶液褪色 |
实验室采购了部分化学药品。下图是从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是 
| A.该硫酸的物质的浓度为9.2 mol·L-1 |
| B.1 mol Al与足量的该硫酸反应产生3 g氢气 |
| C.配制200 mL 2.3 mol·L-1的稀硫酸需量取该硫酸25 mL |
| D.打开浓硫酸的瓶盖,可以看到有白雾出现 |
把物质的量均为0.1 mol的AlCl3、CuCl2和H2SO4溶于水制成100 mL的混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
| A.阳极得到的气体中有O2且为0.35 mol |
| B.铝元素仅以Al(OH)3的形式存在 |
| C.阴极质量增加3.2 g |
| D.电路中共转移0.9 mol电子 |
电镀在工业上有着广泛的应用,可以镀锌、镀铜、镀金等。利用如图所示装置可以将铜牌变为银牌,即在铜牌表面电镀一层银。下列有关说法中正确的是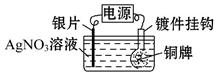
| A.通电后,Ag+向阳极移动 |
| B.银片与电源负极相连 |
C.该电解池的阴极反应可表示为Ag++e- Ag Ag |
| D.当电镀一段时间后,将电源反接,铜牌可恢复如初 |
已知298K时,2SO2(g)+O2(g)  2SO3(g) △H=-197kJ/mol。在相同温度下,向密闭容器通入2mol SO2和1mol O2达平衡时,放热Q1;向另一相同体积的密闭容器中通入1mol SO2和0.5mol O2达平衡时,放出热量Q2,则下列关系式正确的是
2SO3(g) △H=-197kJ/mol。在相同温度下,向密闭容器通入2mol SO2和1mol O2达平衡时,放热Q1;向另一相同体积的密闭容器中通入1mol SO2和0.5mol O2达平衡时,放出热量Q2,则下列关系式正确的是
| A.Q1=Q2/2 | B.Q2<Q1<197kJ |
| C.Q2=Q1<197kJ | D.以上均不正确 |