有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
| A.溶质的质量分数是24.0% |
| B.溶液的物质的量浓度是2.4 mol·L-1 |
| C.溶质和溶剂的物质的量之比是1∶40 |
| D.硫酸根离子的质量分数是19.2% |
下列化学性质中,烷烃不具备的是( )
| A.不能使溴水褪色 |
| B.可以在空气中燃烧 |
| C.与Cl2发生取代反应 |
| D.能使酸性KMnO4溶液褪色 |
实验室制备苯甲醇和苯甲酸的化学原理是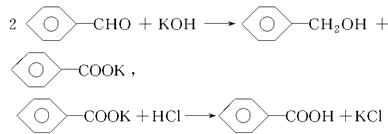
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
试根据上述信息,判断以下说法错误的是( )
| A.操作Ⅰ是萃取分液 |
| B.乙醚溶液中所溶解的主要成分是苯甲醇 |
| C.操作Ⅱ蒸馏所得产品甲是苯甲醇 |
| D.操作Ⅲ过滤得到产品乙是苯甲酸钾 |
在C2H2、C6H6、C2H2O2组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
| A.92.3% | B.87.6% | C.75% | D.84. 9% |
已知某有机物A的红外光谱和核磁共振氢谱如图所示: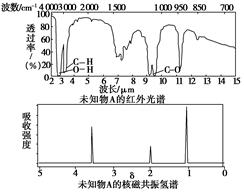
下列说法中不正确的是( )
| A.由红外光谱可知,该有机物中至少有三种不同的化学键 |
| B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 |
| C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
| D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3 |
质谱法能够对有机分子进行结构分析。其方法是让极少量的(10-9 g)化合物通过质谱仪的离子化室,样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化可得到C2H6+、C2H5+、C2H4+……然后测定其质荷比。设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
| A.甲醇(CH3OH) | B.甲烷 | C.丙烷 | D.乙烯 |