下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
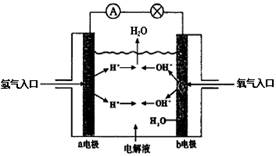
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-=2H2O+O2 |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
下列反应的离子方程式书写正确的是 ()
| A.铝溶于NaOH溶液:2Al +2OH-+H2O="=2" AlO2ˉ+3H2↑ |
| B.氧化铝溶于足量NaOH溶液:Al 2O3+ OH-="=" AlO2ˉ+ H2O |
| C.向氢氧化铝沉淀中加入足量盐酸:Al(OH)3+3H+==Al3++3H2O |
| D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O ="=" AlO2ˉ+4NH4+ |
下列有关厨房中铝制品使用合理的是()
| A.盛放食醋 | B.烧煮开水 | C.用碱水洗涤 | D.用金属丝擦洗表面的污垢 |
X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如右下表。已知:X元素最低负化合价的绝对值与其原子最外层电子数相等,Y是地壳中含量最多的金属元素。下列说法错误的是()
| X |
 |
|||
| Z |
| A.X和氢组成的化合物分子中可能含有极性共价键和非极性共价键 |
| B.工业上用电解Y和W组成的化合物来制备Y |
| C.Z、W两元素的气态氢化物中,W的气态氢化物更稳定 |
| D.X、Y、Z、W元素最高价氧化物对应的水化物中酸性最强的是HWO4 |
MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
⑵ 除去反应混合物中的不溶物 ⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
| A.步骤⑴中MnO2和H2SO4都是氧化剂 |
| B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子 |
| C.步骤(3)中电解时MnO2在阳极处产生 |
| D.硫酸在生产中可循环使用 |
若NA表示阿伏加德罗常数的值,下列叙述正确的是()
①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为a/22.4 NA
③电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
④7 g CnH2n中含有的氢原子数为2NA
⑤常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
⑥1 L 2 mol·L-1 FeCl3溶液中含Fe3+数为2NA
⑦2 L1 mol·L-1的盐酸中所含氯化氢分子数为2NA
| A.①④⑦ | B.②⑥ | C.③④⑤ | D.②⑤ |