某同学设计了一种电解法制取Fe(OH)2的实验装置(如右图)。玻璃管内的电解液为NaCl溶液, 通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:

(1)写出A电极的电极反应式 ;B电极的电极反应式 ;
(2)若电解改用NaOH溶液作电解液,发现电解一开始即出现灰绿色沉淀,该沉淀产生在 极附近(选填“A”或“B”)。试分析为什么用NaCl溶液作电解液时白色沉淀能保持较长时间的原因: 。
烟气脱硫(SO2)脱硝(NOx)一体化技术是大气污染防治研究的热点。烟气中NO通常占NOx总量的90%以上,但NO的脱除难度较大。某研究小组探究用次氯酸钙溶液同时脱除烟气中SO2和NO的方法。
脱硫:Ca(ClO)2(aq) + 2SO2(g) + 2H2O(l)=CaSO4(s) + H2SO4(aq) + 2HCl(aq) Ⅰ
脱硝:3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l)=3CaCl2(aq) + 4HNO3(aq) Ⅱ
请回答:
(1)脱硫过程涉及的各化学反应及其ΔH如下:
SO2(g) + H2O(l)  H2SO3(aq) ΔH=a
H2SO3(aq) ΔH=a
Ca(ClO)2(aq) + H2SO3(aq) = CaSO3(s) + 2HClO(aq) ΔH=b
CaSO3(s) + HClO(aq) = CaSO4(s) + HCl(aq) ΔH=c
H2SO3(aq) + HClO(aq) = H2SO4(aq) + HCl(aq) ΔH=d
脱硫反应Ⅰ的ΔH1= 。
(2)脱硫反应Ⅰ和脱硝反应Ⅱ的平衡常数随温度的变化如下图所示:
①判断反应Ⅱ的ΔS2 0、ΔH2 0(填<、=或>),指出有利于自发进行的温度条件是 (填“较高温度”或“较低温度”)。
②预测用次氯酸钙溶液脱硫脱硝反应进行的程度并说明理由 。
(3)与NaClO溶液吸收法相比,Ca(ClO)2法更能促进脱硫反应进行,理由是 。
(4)与NaOH溶液吸收法相比,Ca(ClO)2法的脱硫脱硝效率更高,理由是 。
一定条件下,无机物可以转化为有机物。例如,干冰与液氨反应可生成氨基甲酸铵(NH2COONH4),氨基甲酸铵受热可转化为尿素[CO(NH2)2]。新近研究发现,海底热液中有CO2和H2等无机物,还有可能通过非生物途径形成的CH4等烃类。
请回答:
(1)干冰的结构式 。
(2)干冰与液氨反应生成氨基甲酸铵的化学方程式 。
(3)氨基甲酸铵受热转化为尿素的化学方程式 。
(4)有人推测,海底热液中CH4由CO2和H2反应生成。从氧化还原反应的角度说明该推测的合理性 。
(5) 也有人推测,海底热液中的CH4由海底矿物直接生成。热液条件(如50 MPa,300 ℃)下,矿物中NaHCO3、Fe与H2O反应可生成CH4的化学方程式 。
(6)探究某矿物(xNa2CO3 ·yNaHCO3·zH2O)组成:取22.60 g试样分成两等份后进行实验。一份用酒精灯加热至恒重(270),得到固体质量为7.95 g;另一份加入足量酸,放出的气体通入过量的澄清石灰水,得到白色沉淀10.00 g。该矿物的化学式是 (用x、y、z的最简整数比表示)。
(7)BaSO4不溶于酸,若用饱和Na2CO3溶液处理可转化为溶于酸的BaCO3,沉淀转化反应的离子方程式是 。
参考下列图表和有关要求回答问题: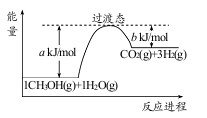
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。右图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是_____ (填“增大”、“减小”、“不变”),反应热△H的变化是_____(填“增大”、“减小”、“不变”)。请写反应进程出CH3OH(g)和H2O(g)反应的热化学方程式_____。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+1/2O2(g) CO2(g)+2H2(g) △H="c" kJ/mol
CO2(g)+2H2(g) △H="c" kJ/mol
又知H2O(g) H2O(l) △H="d" kJ/mol。
H2O(l) △H="d" kJ/mol。
则甲醇燃烧生成液态水的热化学方程式为_____。
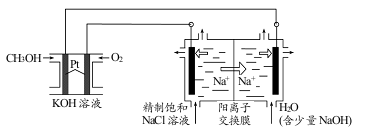
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH=_____,负极反应式为_____。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为_____。
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_____mol。
T1温度下,体积为 2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如表格所示。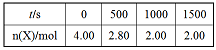
(1)前500s反应速率v(M)=_____,该反应的平衡常数K=_____。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____(填序号)
a.X的消耗速率与M的消耗速率相等 b.混合气体的平均相对分子质量不变
c.v(Y)与v(M)的比值不变 d.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____。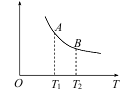
a.Y的逆反应速率
b.M的体积分数
c.混合气体的平均相对分子质量
d.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____。
| A.平衡不移动 |
| B.重新达平衡后,M的体积分数小于50% |
| C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍 |
| D.重新达平衡后,Y的平均反应速率与原平衡不相等 |
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____1.5mol/L(填“>”、“=”或“<”),理由是_____。
I.H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为____________________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_______________。
A.c(Na+ )>c(K+) B.c(H +)•c(OH)=1×10-14
C.c(Na+ )=c(K+) D.c(Na+ )+c(K+ )=c(HA-)+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含4.00×10-3 mol/L的Cr2O72-。为使废水能达标排放,作如下处理:
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_______________。
(2)欲使25 L该废水中Cr2O7转化为Cr3+,理论上需要加入__________g FeSO4·7H2O。
(3)若处理后的废水中残留的c(Fe)=1×10-13mol/L,则残留的 Cr3+的浓度为__________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol/L,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )