下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是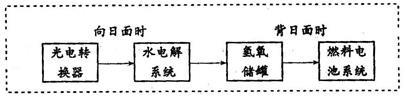
| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑ |
| D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
用惰性电极以直流电串联电解分装在甲、乙两烧杯中的200mL0.3 mol·L-1 NaCl溶液和300mL0.2 mol·L-1的AgNO3溶液,当产生0.56L(标准状况下)Cl2时停止电解,取出电极,将两杯溶液混合,则混合液的pH为(设混合后溶液的总体积为500mL)()
| A.1.4 | B.7 | C.5.6 | D.12.6 |
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?) xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )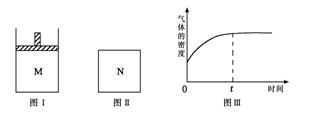
A.x=4
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)  bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )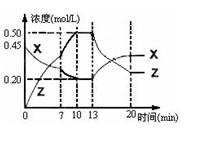
| A.用X表示0~10min内该反应的平均速率为0.025 mol/(L·min) |
| B.根据上图可求得方程式中a:b=2:1 |
| C.0~10min 容器内气体的压强逐渐增小 |
| D.第13min时曲线变化的原因可能是增加了Z的量 |
已知可逆反应2NO2(g) N2O4(g);△H<0,在一定条件下,反应达到平衡后,改变下列条件,再次达到平衡后,容器中气体颜色加深的是()
N2O4(g);△H<0,在一定条件下,反应达到平衡后,改变下列条件,再次达到平衡后,容器中气体颜色加深的是()
①减小容器体积 ②升高温度
③定容下充入NO2气体 ④定压下充入NO2气体
| A.①②③④ | B.①②③ | C.①② | D.①③ |
下列关于各图的说法,正确的是()
| A.①装置中阴极处产生的气体能够使湿润淀粉KI试纸变蓝 |
| B.②装置中待镀铁制品应与电源正极相连 |
| C.③装置中电子由b极流向a极 |
| D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |