下列反应中,熵变小于0的是
| A.(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) |
| B.2N2O5(g)=4NO2(g)+O2(g) |
| C.MgCO3(s)=MgO(s)+CO2(g) |
| D.2CO(g)=2C(s)+O2(g) |
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)  H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
| A.25% | B.50% | C.75% | D.80% |
对于可逆反应3H2+N2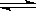 2NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
| A.增大压强 | B.充入更多N2 | C.使用高效催化剂 | D.降低温度 |
右图为可逆反应A(g)+2B(g) nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强P1、P2的关系正确的是
nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强P1、P2的关系正确的是
| A.P2>P1,n<3 |
| B.P2>P1,n>3 |
| C.P1>P2,n<3 |
| D.P1>P2,n>3 |
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% |
| C.小于p% | D.无法判断 |
反应CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度自发向右进行,若反应的|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ·mol-1,则下列正确的
| A.ΔH>0,ΔH-TΔS<0 | B.ΔH<0,ΔH-TΔS>0 |
| C.ΔH>0,ΔH-TΔS>0 | D.ΔH<0,ΔH-TΔS<0 |