反应CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度自发向右进行,若反应的|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ·mol-1,则下列正确的
| A.ΔH>0,ΔH-TΔS<0 | B.ΔH<0,ΔH-TΔS>0 |
| C.ΔH>0,ΔH-TΔS>0 | D.ΔH<0,ΔH-TΔS<0 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是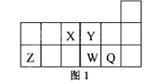
| A.元素X与元素Z的最高正化合价之和的数值等于7 |
| B.原子半径的大小顺序为:rZ>rW>rQ >rY> rX |
| C.离子Y2-和Z 3+的核外电子数、电子层数和质子数都相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
下列选用的相关仪器符合实验要求的是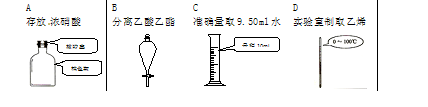
在FeCl3与CuCl2的混合溶液中加入过量的铁粉,反应完毕后,剩余固体的质量恰好与所加铁粉的质量相等,则原混合液中FeCl3与CuCl2的物质的量之比为
| A.5∶2 | B.4∶3 | C.2∶7 | D.7∶4 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是
| A.常温下,23g NO2含有NA个氧原子 |
| B.1L0.1mol?L-1的氨水含有0.1NA个OH― |
| C.常温常压下,22.4LCCl4含有个NA个CCl4分子 |
| D.1molFe2+ 与足量的H2O2溶液反应,转移2NA个电子 |
室温下,下列各组离子在指定溶液中一定能大量共存的是
| A.饱和氯水中 Cl-、NO3-、Na+、SO32- | B.强酸性的溶液中 C6H5O-、K+、SO42-、Br- |
| C.Na2S溶液中 SO42-、K+、Cl-、Cu2+ | D.强碱性的溶液中 NO3-、I-、Na+、AlO2- |